
分析 根据有机物分子式可知C11H16不饱和度为4,不能因反应而使溴水褪色,说明该有机物分子中不存在C=C双键、C≡C三键,分子中除苯环外不含其它环状结构,苯环的不饱和度为4,所以,含有1个苯环,侧链为烷基,烷基的组成为-C5H11.能使酸性KMnO4溶液褪色,说明烷基连接苯环的C原子含有H原子,烷基组成结构为-CH2-C4H9或-CH(CH3)-C3H7或-CH(C2H5)2,通过判断-CH2-C4H9中-C4H9、-CH(CH3)-C3H7中-C3H7、-CH(C2H5)2中-C2H5异构数目,判断符合条件的有机物的可能的结构.
解答 解:根据有机物分子式可知C11H16不饱和度为4,不能因反应而使溴水褪色,说明该有机物分子中不存在C=C双键、C≡C三键,分子中除苯环外不含其它环状结构,苯环的不饱和度为4,所以,含有1个苯环,侧链为烷基,烷基的组成为-C5H11.能使酸性KMnO4溶液褪色,说明烷基连接苯环的C原子含有H原子,烷基组成结构为-CH2-C4H9或-CH(CH3)-C3H7或-CH(C2H5)2.
若烷基为-CH2-C4H9,-C4H9的异构体有: ,故有4种异构体;
,故有4种异构体;
若烷基为-CH(CH3)-C3H7,-C3H7的异构体有:正丙基、异丙基两种,故有2种异构体;
若烷基为-CH(C2H5)2,-C2H5没有异构体,结构只有1种.
故符合条件的有机物的可能的结构有4+2+1=7.
故选:C.
点评 本题考查了限制条件同分异构体的书写,难度中等,侧重考查学生解题思维与解题方法,确定烷基连接苯环的C原子含有H原子是解题关键,再讨论连接苯环C原子上连接的烷基情况,根据烷基异构进行判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈中性,可选用甲基橙或酚酞作指示剂 | |
| B. | 溶液呈中性,只能选用石蕊作指示剂 | |
| C. | 溶液呈碱性,可选用甲基橙或酚酞作指示剂 | |
| D. | 溶液呈碱性,只能选用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
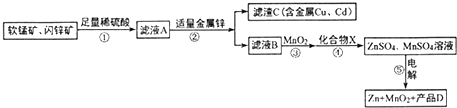
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
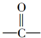 与HCN反应引入:
与HCN反应引入: $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$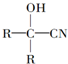
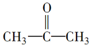 $→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D
$→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D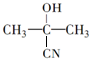 ,D
,D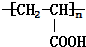 .
.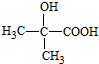 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.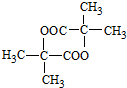 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或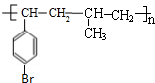 .
.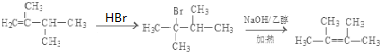 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ;⑪
;⑪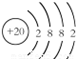 .
. ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com