
【题目】(1)M2O7x- 与S2-在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+=2M3++3S+7H2O,则x等于________ ,氧化产物与还原产物的物质的量比为_______。
(2)NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合反应的离子方程式_____;
(3)用单线桥标出该反应中电子转移的方向和数目________
Fe3O4 +4CO![]() 3Fe+4CO2
3Fe+4CO2
(4)过量CO2通入NaOH溶液中的离子方程式__________________;
【答案】2 3:2 H+ + SO42-+ Ba2+ + OH- = H2O+ BaSO4 ↓ ![]() CO2 + OH- = HCO3-
CO2 + OH- = HCO3-
【解析】
(1)根据电荷守恒分析x的值。根据化合价的变化确定氧化产物和还原产物,结合离子方程式和得失电子守恒确定氧化产物与还原产物物质的量之比。
(2)NaHSO4与Ba(OH)2按物质的量之比1:1反应的离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O。
(3)反应中,C元素的化合价由+2价升至+4价,Fe3O4中1个Fe为+2价、2个Fe为+3价,Fe3O4中Fe元素的化合价都降为0价,反应中转移8e-。
(4)过量CO2通入NaOH溶液中反应的离子方程式为CO2+OH-=HCO3-。
(1)离子反应满足电荷守恒,则(-x)+3×(-2)+14×(+1)=2×(+3),解得x=2。x=2,则M2O7x-中M的化合价为+6价,反应中M元素的化合价由+6价降至+3价,M3+为还原产物,S元素的化合价由-2价升至0价,S为氧化产物,根据得失电子守恒和离子方程式,氧化产物与还原产物物质的量之比为3:2。
(2)NaHSO4与Ba(OH)2按物质的量之比1:1反应的化学方程式为NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH,离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O。
(3)反应中,C元素的化合价由+2价升至+4价,Fe3O4中1个Fe为+2价、2个Fe为+3价,Fe3O4中Fe元素的化合价都降为0价,反应中转移8e-,用单线桥标出电子转移方向和数目为![]() 。
。
(4)过量CO2通入NaOH溶液中反应的化学方程式为CO2+NaOH=NaHCO3,离子方程式为CO2+OH-=HCO3-。


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】乙烯被称为“工业血液”,下列有关乙烯的叙述中错误的是
A. 乙烯分子是平面型分子
B. 乙烯能发生加成、氧化反应
C. 工业上采用乙醇和浓硫酸共热的方法获得大量的乙烯
D. 乙烯是一种植物生长调节剂,可用以催熟果实
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
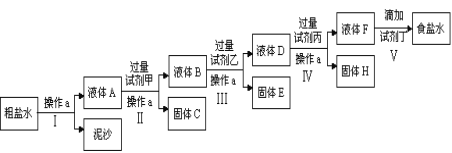
请回答以下问题:
(1)操作a的名称是______________,所用玻璃仪器有_________________;
(2)在第Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)_______________溶液;
(3)写出固体H所含物质的化学式_________________________________;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式____________________________________________。
(二)某次实验需用0.4 mol·L-1 NaOH溶液500 mL。若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏低的是__________,对实验结果没有影响的是________(填字母代号)。
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应对应的离子方程式正确的是( )
A. 向AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C. 向NaHSO4溶液中加足量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D. 向含3molNaClO溶液中通入1molSO2:3ClO-+H2O+SO2=2HClO+SO42-+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A. 元素Y、Z、W形成的简单离子具有相同电子层结构,其半径依次增大
B. 元素Y、R分别与元素X形成的化合物的稳定性:XmY强于XmR
C. 元素Z、Y形成的1mol化合物中含有的分子数约为1.806×1024
D. 元素Z、R的最高价氧化物水化物之间相互反应生成的盐溶液呈中性或碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 是同一周期的四种元素。A、B、C 的原子序数依次相差为 1,A 元素的单质的化 学性质活泼,A 元素的原子在本周期中第一电离能最小。B 元素的氧化物 2.0g 恰好跟 100mL 0.5molL1硫酸完全反应。B 元素单质跟 D 元素单质反应生成化合物 BD2。根据以上事实,填写下列空白:
(1)A 的原子结构示意图:_____,C 原子的电子式为_____;
(2)BD2 的电子式为_____;若向 C 的氧化物的水化物中加入 A 的氧化物的水化物,则溶液 显碱性。这一反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体
B. H—O键键能为463 kJ/mol,即18gH2O分解成H2和O2时,消耗能量为2×463 kJ
C. sp3杂化轨道是由同一原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com