
【题目】A、B、C、D 是同一周期的四种元素。A、B、C 的原子序数依次相差为 1,A 元素的单质的化 学性质活泼,A 元素的原子在本周期中第一电离能最小。B 元素的氧化物 2.0g 恰好跟 100mL 0.5molL1硫酸完全反应。B 元素单质跟 D 元素单质反应生成化合物 BD2。根据以上事实,填写下列空白:
(1)A 的原子结构示意图:_____,C 原子的电子式为_____;
(2)BD2 的电子式为_____;若向 C 的氧化物的水化物中加入 A 的氧化物的水化物,则溶液 显碱性。这一反应的离子方程式是_________。
【答案】 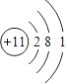
![]()
![]() Al(OH)3+ OH-== AlO2-+2H2O
Al(OH)3+ OH-== AlO2-+2H2O
【解析】A、B、C、D是同一周期的四种元素,A元素的原子在本周期中第一电离能最小,则A处于ⅠA族,A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族,B的氧化物能与酸反应,其氧化物中B显+2价,B元素的氧化物2.0g恰好跟100mL0.5molL-1硫酸完全,则BO的物质的量等于硫酸的物质的量为0.1L×0.5mol/L=0.05mol,则BO的相对分子质量=![]() =40g/mol,则B的相对原子质量为40-16=24,所以B是Mg元素,则A是Na元素,C是Al元素;B元素单质跟D元素单质反应生成化合物BD2,则化合物中D表现-1价,则D为Cl元素。
=40g/mol,则B的相对原子质量为40-16=24,所以B是Mg元素,则A是Na元素,C是Al元素;B元素单质跟D元素单质反应生成化合物BD2,则化合物中D表现-1价,则D为Cl元素。
(1)A为Na元素,原子核外有11个电子,其原子结构示意图为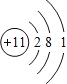 ,C为Al元素,铝原子的电子式为
,C为Al元素,铝原子的电子式为![]() ,故答案为:
,故答案为: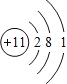 ;
;![]() ;
;
(2)MgCl2 的电子式为![]() ,C的氧化物的水化物为Al(OH)3,A的氧化物的水化物为NaOH,二者反应生成NaAlO2与水,反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,反应的离子方程式为Al(OH)3 + OH-== AlO2- +2H2O,故答案为:
,C的氧化物的水化物为Al(OH)3,A的氧化物的水化物为NaOH,二者反应生成NaAlO2与水,反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,反应的离子方程式为Al(OH)3 + OH-== AlO2- +2H2O,故答案为:![]() ;Al(OH)3 + OH-== AlO2- +2H2O。
;Al(OH)3 + OH-== AlO2- +2H2O。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】已知微粒间的相互作用有以下几种:
①离子键 ②极性共价键 ③非极性共价键 ④氢键 ⑤分子间作用力
下面是某同学对一些变化过程破坏的微粒间的相互作用的判断:
A.干冰熔化②⑤ B.氢氧化钠溶于水①
C.氯化氢气体溶于水 ②④ D.冰熔化②④
其中判断正确选项的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下几个反应:
①Cl2+2KI===2KCl+I2 ②2FeCl2+Cl2===2FeCl3
③2FeCl3+2KI===2FeCl2+2KCl+I2
④I2+SO2+2H2O===H2SO4+2HI
判断氧化性由强到弱的顺序是
A. Cl2>I2>Fe3+>SO2 B. Cl2>Fe3+>I2>SO2
C. Cl2>Fe3+>SO2>I2 D. Fe3+>I2>Cl2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100 mL0.3mol/L和300 mL0.25mol/L的硫酸注入500 mL的容量瓶中,加水稀释至刻度线,则该混合液中H+的物质的量浓度为
A. 0.21mol/L B. 0.26mol/L C. 0.42mol/L D. 0.56mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M2O7x- 与S2-在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+=2M3++3S+7H2O,则x等于________ ,氧化产物与还原产物的物质的量比为_______。
(2)NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合反应的离子方程式_____;
(3)用单线桥标出该反应中电子转移的方向和数目________
Fe3O4 +4CO![]() 3Fe+4CO2
3Fe+4CO2
(4)过量CO2通入NaOH溶液中的离子方程式__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)2011年,内蒙古、新疆、浙江等地都要陆续召开各具特色的农博会,到时“生态农业”将成为农会人员关注的热门话题。生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO![]() CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是________。
(2)原混合气体中氮气的体积分数为________。
(二)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为___________________
(三)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
已知0.2 mol KBrO3在反应中得到1 mol电子生成X,请将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_________________
![]() +
+![]()
(四) 在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)、过氧化钠为原料制取氧气,当制得同温、同压下相同体积的O2时,四个反应中转移的电子数之比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③ B. ①⑤⑥ C. ②③④ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是 I1=738 kJ/mol;I2=1 451 kJ/mol;I3=7 733 kJ/mol;I4=10 540 kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式______________________________。
(2)B基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() 该同学所画的电子排布图违背了_____________________________________。
该同学所画的电子排布图违背了_____________________________________。
(4)G位于________族________区,价电子排布式为________。
(5)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因是_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com