
【题目】如图是乙醇燃料电池的实验装置图,下列有关说法一定正确的是( ) 
A.若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极
B.甲池中负极的电极反应式为:CH3CH2OH﹣12e﹣+3H2O=2CO2+12H+
C.甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.04g
D.M电极上的电极反应式为:Ag++e﹣=Ag
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
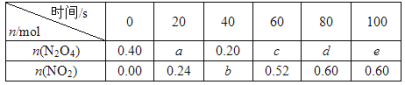
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
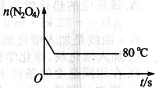
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是( )
A.长期放置的苯酚晶体变红B.硝酸银晶体光照后变黑
C.氢氧化亚铁变灰绿再变红褐D.二氧化氮气体冷却后变淡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,可行的是 ( )
A.将白醋滴在润湿的pH试纸上,测定其pH
B.按溶解、过滤、蒸发的操作顺序分离CaCl2、CaCO3的混合物
C.用氢氧化钠溶液除去CO2中的HCl气体
D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.25℃时,100mLPH=1的CH3COOH溶液中含有的H+总数大于0.01NA
B.标准状况下,11g3H216O种含有的质子数为6NA
C.1molLi2O和Na2O2的混合物中含有的离子总数为3NA
D.1molN2与足量H2混合,充分反映后转移电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请配平下列化学方程式。
![]() _____________
_____________
(2)反应物中被氧化的元素_________,还原产物是________。
(3)反应中每生成标况下22.4L ![]() ,转移_______mol电子。
,转移_______mol电子。
(4)反应中氧化剂与还原剂物质的量之比____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是(填序号).
A.HCN
B.HClO
C.CH3COOH
D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:
(3)碳酸氢钠是一种(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3﹣、H2CO3、CO32﹣、OH﹣五种微粒浓度由大到小的顺序为: .
(4)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:
②几种离子开始沉淀时的pH下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,(填离子符号)先沉淀,Ksp[Fe(OH)3]Ksp[Mg(OH)2](填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 . ( Ksp[Cu(OH)2]=2×10﹣20 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系,填写下列空白。

(1)确定A、B、C、D、E、F的化学式,A为_______,B为_______,C为_______,D为_______,E为_______,F为_______。
(2)写出⑧现象和化学方程式,④、⑤的离子方程式:
⑧现象______________________;化学方程式______________________;④的离子方程式______________________;⑤的离子方程式______________________;
(3)设计实验检验D溶液中的金属阳离子______________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com