
【题目】室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO45H2O受热分解的化学方程式为:CuSO45H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3 C.△H1+△H3=△H2 D.△H1+△H2>△H3
【答案】B
【解析】
试题分析:①胆矾溶于水时,溶液温度降低,反应为CuSO45H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0;②硫酸铜溶于水,溶液温度升高,该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0;③已知CuSO45H2O(s)=CuSO4(s)+5H2O(l)△H3;依据盖斯定律①-②得到③:△H3=△H1-△H2,由于△H2<0,△H1>0,则△H3>0,A.上述分析可知:△H2<0,△H1>0,则△H2<△H3,A错误;B.分析可知△H3>0,而△H2<0,则△H3>△H1,B正确;C.△H3=△H1-△H2,则△H1=△H3+△H2,C错误;D.△H2<0,△H1>0,且△H1=△H3+△H2,则△H3>△H1+△H2,D错误;答案选B。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+ = H2O+S↓+SO2↑)

(1) 为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是 ;除如图所示的实验用品、仪器外,还需要的一件实验仪器是______ 。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是 。
(3)试简述测定该反应的化学反应速率的其他方法(写一种):
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32- = S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0[ | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是 ,表中Vx= mL,比较t1、t2、t3大小,试推测该实验结论:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. ![]() 的溶液中:Na+、K+、SiO32—、SO32-
的溶液中:Na+、K+、SiO32—、SO32-
B. pH=1的溶液中:K+、Al3+、SO42-、F—
C. 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl-
D. 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

(1)该条件下反应平衡常数表达式K=______________;在t1 ℃时,反应的平衡常数为____________,达到平衡时n(CH3OCH3):n(CH3OH):n(H2O)=_____________________。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为:c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4mol·L-1,此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”),反应向__________反应方向进行(填“正”或“逆”).。
Ⅱ.已知可逆反应:M(g)+N(g) ![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个由n条多肽链组成的蛋白质分子共有m个氨基酸,该蛋白质分子完全水解共需多少个水分子( )
A. n个 B. m个 C. (m+n)个 D. (m-n)个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
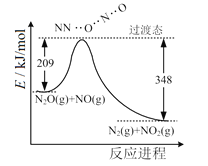
A.反应生成1mol N2时转移4 mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g) = N2(g)+NO2(g) △H=-139kJ/mol
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
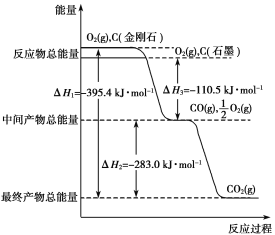
(1)等质量的金刚石和石墨完全燃烧,____________(填“金刚石”或“石墨”)放出的热量更多,写出表示石墨燃烧热的热化学方程式:_______________________。注意:石墨用“C(石墨,s)”表示。
(2)在通常状况下,____________(填“金刚石”或“石墨”)更稳定。
(3)6 g石墨在一定量空气中燃烧,生成气体18 g,该过程中放出的热量为______________kJ。
Ⅱ.白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
4P(红磷,s)+5O2(g)= 4 P4O10(s) ΔH2=-2954 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式:4P(红磷,s) ==P4(白磷,s)ΔH=____________
(2)已知298 K时白磷不完全燃烧的热化学方程式为:P4(白磷,s)+3O2(g)=P4O6(s) ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为_________________,反应过程中放出的热量为___________kJ。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):
P—P:198,Cl—Cl :243,P—Cl:331。
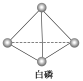
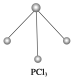
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是

A.外电路电子从B极移向A极[来
B.溶液中H+由B极区移向A极区
C.电池工作一段时间后B极区溶液的pH减小[
D.A极电极反应式为:CH3COOH - 8e-+ 2H2O = 2CO2 + 8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2。符合上述转化关系的A、C可能是

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com