
【题目】一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2。符合上述转化关系的A、C可能是

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
【答案】A
【解析】
试题分析:①Fe在氯气中燃烧生成FeCl3,不存在上述转化,故不选;②为C在少量氧气中燃烧生成CO,CO继续在氧气中燃烧生成CO2,C可在足量氧气中燃烧生成CO2,符合,故选;③为AlCl3与少量NaOH溶液反应生成Al(OH)3 ,继续滴加过量NaOH溶液则生成NaAlO2的转化,AlCl3与过量NaOH溶液作用可直接生成NaAlO2,符合,故选;④为NaOH与CO2反应生成Na2CO3,继续通入CO2则生成NaHCO3,NaOH溶液里通足量CO2可直接生成NaHCO3,故选;⑤S与氧气不能反应生成SO3,不符合A、X的转化,故不选;⑥为Na2CO3溶液中滴加少量HCl可生成NaHCO3 ,继续滴加过量HCl,可生成CO2的转化,Na2CO3与过量稀盐酸作用生成CO2,符合转化关系,故选;故选A。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO45H2O受热分解的化学方程式为:CuSO45H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3 C.△H1+△H3=△H2 D.△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g) △H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g) △H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
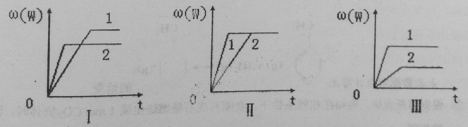
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图I可能是不同压强对反应的影响,且p2>p1,a+b>n
B.图II可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图II可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
D.图III可能是不同温度对反应的影响,且T1>T2,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 铁与稀H2SO4反应时,加入少量CuSO4溶液,可使反应速率加快
B. 构成原电池的正极和负极必须是两种不同的金属
C. 在铁上镀铜时,金属铜作阴极
D. 用惰性电极电解CuSO4溶液,溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将废旧锌锰电池处理得到含锰混合物,既能减少它对环境的污染,又能实现废电池的资源化利用。
Ⅰ. 回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
(1)写出MnO(OH)与浓盐酸反应的化学方程式:_________。
Ⅱ. 锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH + MnO2 + 2H2C2O4 + 3H2SO4 == 3MnSO4 + 4CO2↑ + 6H2O
(2)与使用浓盐酸回收锰相比,新方法的优点是_________(答1点即可)。
(3)欲以MnSO4溶液为原料制备MnCO3,选用的加料方式___________(填字母),原因是___________。
已知:Ksp(MnCO3)=2.3×10﹣11、Ksp[Mn(OH)2]=2.1×10﹣13
a. 将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b. 将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c. 将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d. 以上三种方式都无法得到MnCO3.
Ⅲ. 现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示:
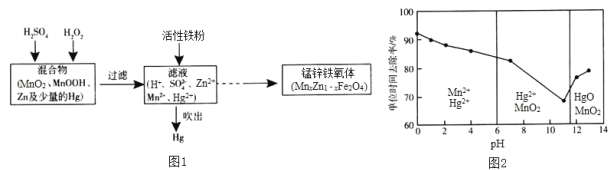
请回答下列问题:
(4)MnxZn1﹣xFe2O4中铁元素化合价为+3,则锰元素的化合价为___________。
(5)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(6)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为__________________。
(7)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如图2所示:
①写出pH=10时KMnO4溶液吸收汞蒸气的离子方程式________________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4溶液的氧化性增强外,还可能是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
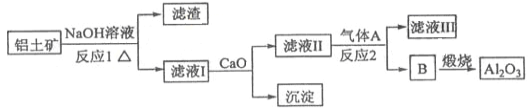
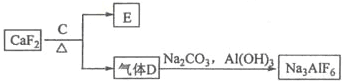
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式__________________________;
(2)滤液Ⅰ中加入CaO生成的沉淀是____________,反应2的离子方程式为____________________;
(3)E可作为建筑材料,化合物C是__________,写出由D制备冰晶石的化学方程式____________;
(4)电解制铝的化学方程式是__________________,以石墨为电极,阳极产生的混合气体的成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯和乙醇均能被酸性高锰酸钾溶液氧化
B. 甲烷和苯均可在光照的条件下与氯气发生取代反应
C. 分子式为C2H6O的有机物均可在一定条件下与乙酸发生酯化反应
D. 蛋白质、油脂、葡萄糖均可在一定条件下发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com