
【题目】下列关于实验描述正确的是
A. 向浓氨水中滴加饱和![]() 溶液,可以制得
溶液,可以制得![]() 胶体
胶体
B. 为除去Mg(OH)2 固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤,再水洗、干燥
C. 向溶液 X 中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液 X 中含有CO32-
D. 卤代烃Y与NaOH醇溶液共热后,恢复至室温,再滴加AgNO3 溶液,产生白色沉淀,说明卤代烃Y中含有氯原子
【答案】B
【解析】
A.浓氨水和饱和氯化铁溶液产生红褐色氢氧化铁沉淀,氢氧化铁胶体的制备方法:在沸腾的蒸馏水中加入饱和氯化铁溶液加热,当溶液变为红褐色时应立即停止加热,故A错误;B.氢氧化物表示方法相同时,溶度积常数大的物质能转化为溶度积常数小的物质,氢氧化镁溶度积常数小于氢氧化钙,所以可用饱和MgCl2溶液多次洗涤后可以除去氢氧化镁中的氢氧化钙,故B正确;C.碳酸根离子、碳酸氢根离子都能与稀盐酸反应生成无色无味且能使澄清石灰水变浑浊的气体,所以原溶液中可能含有碳酸氢根离子,故C错误;D.卤代烃中卤元素的检验时,先将卤元素转化为卤离子,然后应该先加入稀硝酸中和未反应的NaOH,再用硝酸银检验卤离子,否则无法达到实验目的,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】碳酸锰是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。工业上用软锰矿(主要成分是MnO2·MnO,含有少量Fe2O3、Al2O3、SiO2)制备碳酸锰的流程如下:
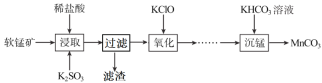
(1)“浸取”步骤中,MnO2·MnO发生反应的离子方程式为___,还能被K2SO3还原的物质有___(填化学式)。“过滤”时滤渣的主要成分是___。
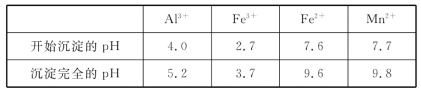
(2)如表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液离子浓度低于1.0×10-5mol·L-1),请补充完整由“氧化”后的溶液制备MnCO3的实验方案:向“氧化”后的溶液中加入____,调pH为___,___,得较纯MnCl2溶液,加入KHCO3溶液沉锰得MnCO3。(实验中可能用到的试剂为K2CO3溶液、盐酸)。
(3)“沉锰”步骤的离子方程式为___,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___。
(4)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:Mn2++S2O82-+H2O---H++SO42-+MnO4-
①请配平上述离子方程式___;
②确认Mn2+离子已经完全反应的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
A.62(a+b) gB.186(a+b) gC.![]() molD.
molD.![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A-F 为中学化学常见物质,它们的焰色试验均为黄色。其中 A 为单质, B 与 C的组成元素相同,且 B 为淡黄色固体; D、 E、 F 的溶液均显碱性,其中 E 和 F 属于盐且相同物质的量浓度的溶液, E溶液的碱性更强。它们之间的相互转化关系如下图。(“![]() ”表示进一步反应即可转化,部分反应物、生成物和反应条件已略去)
”表示进一步反应即可转化,部分反应物、生成物和反应条件已略去)
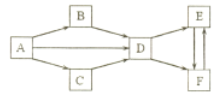
请回答下列问题:
(1)写出下列物质的化学式: B___, C___, E___。
(2)A![]() D 的化学方程式是_______________________。
D 的化学方程式是_______________________。
(3)B![]() D 的化学方程式是_______________________。
D 的化学方程式是_______________________。
(4)区分 E 和 F 两种固体的方法是:分别取等量的 E 和 F 两种固体少许于试管中,具体的操作现象和结论是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
A. 2H2 (g)+O2 (g) == 2H2O(g);H =-Q1 2H2 (g)+O2 (g) == 2H2O(l);H = -Q2
B. S(g)+O2 (g) ![]() SO2 (g);H = -Q1 S(s)+O2 (g)
SO2 (g);H = -Q1 S(s)+O2 (g) ![]() SO2 (g);H = -Q2
SO2 (g);H = -Q2
C. C(s)+O2 (g) == CO2 (g);H = -Q1 C(s)+1/2O2 (g) == CO(g);H = -Q2
D. H2(g)+Cl2(g) == 2HCl(g);H =-Q1 1/2H2(g)+1/2Cl2(g) == HCl(g);H =-Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com