
【题目】a mol FeS与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
A.62(a+b) gB.186(a+b) gC.![]() molD.
molD.![]() mol
mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】研究和开发CO、CO2的应用及水体污染的治理是化学工作者研究的重要课题。
(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HClO除去。已知: NH4++HClO=NH2Cl+H++H2O;ΔH=a kJ·mol-1
NH4++4HClO=NO3- +6H++4Cl-+H2O;ΔH=b kJ·mol-1。
2NH2Cl+HClO=N2+H2O+3H++3Cl-;ΔH=c kJ·mol-1
则2NH4++3HClO=N2+3H2O+5H++3Cl-;ΔH=_____ kJ·mol-1
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2![]() 2Na2CO3+C。放电时当电路中转移1mol电子时被还原的CO2的质量为_____;充电时,阳极的反应式为________
2Na2CO3+C。放电时当电路中转移1mol电子时被还原的CO2的质量为_____;充电时,阳极的反应式为________
(3)废水中重金属离子常用沉淀法除去,已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5 mol·L-1,铜低于7.8×10-5 mol·L-1。则需要控制溶液中S2-的浓度不低于_____________mol·L-1。
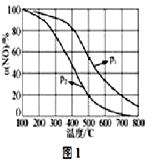
(4)NO易被O2氧化为NO2。其他条件不变时,NO的氧化率α(NO)与温度、压强的关系如图1所示(p1线在p2的上方)则p1__p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是____
(5)环境中的有害物质常通过转化为CO2来降低污染,TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。下图2为在TiO2的催化下,O3降解CH3CHO的示意图,则该反应的化学方程式为_____。
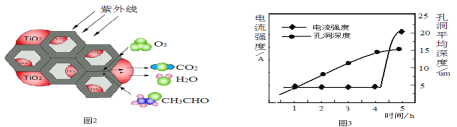
(6)用新型钛基纳米PbO2作电极可将苯、酚类等降解为CO2 和H2O。该电极可通过下面过程制备:将钛基板用丙酮浸泡后再用水冲洗,在钛板上镀上一层铝膜。用它做阳极在草酸溶液中电解,一段时间后,铝被氧化为氧化铝并同时形成孔洞。再用Pb(NO3)2溶液处理得纳米PbO2,除去多余的氧化铝,获得钛基纳米PbO2电极。电解时,电流强度和基板孔洞深度随时间变化如上图3所示,氧化的终点电流强度突然增加,其可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法正确的是
A. 在标准状况下,4.48L水中含有的分子数目为0.2NA
B. 0.1mol![]() 离子含有的电子、中子数均为1.0NA
离子含有的电子、中子数均为1.0NA
C. 一定条件下,0.1mol![]() 与0.3mol
与0.3mol![]() 充分反应后的0.1NA个分子
充分反应后的0.1NA个分子
D. 总物质的量为0.1mol的CaO和![]() 混合物中,所含离子总数为0.2NA
混合物中,所含离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茅台酒中存在少量具有凤梨香味的物质X,其结构如下图所示,下列说法正确的是
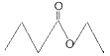
A. X难溶于乙醇
B. 酒中少量的丁酸能抑制X的水解
C. X完全燃烧后生成CO2和H2O的物质的量比为1:2
D. 分子式为![]() 且官能团与X相同的物质共有5种
且官能团与X相同的物质共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
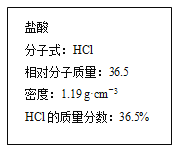
(1)该浓盐酸中HCl的物质的量浓度为________mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②配制仪器除烧杯、玻璃棒、量筒,还需要的仪器是 _______、
③配制时,下列操作正确的顺序是(用字母表示)______。
A. 洗涤 B. 定容 C. 稀释 D. 摇匀 E. 冷却 F. 量取 G. 转移
④在配制过程中,下列实验操作使配制的稀盐酸的物质的量浓度偏小的是_______
A. 用量筒量取浓盐酸时俯视刻度线
B. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C. 配制时,容量瓶有少量蒸馏水
D. 定容时俯视容量瓶的刻度线
E. 转移完溶液后未洗涤玻璃棒和烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验描述正确的是
A. 向浓氨水中滴加饱和![]() 溶液,可以制得
溶液,可以制得![]() 胶体
胶体
B. 为除去Mg(OH)2 固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤,再水洗、干燥
C. 向溶液 X 中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液 X 中含有CO32-
D. 卤代烃Y与NaOH醇溶液共热后,恢复至室温,再滴加AgNO3 溶液,产生白色沉淀,说明卤代烃Y中含有氯原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种重要的有机中间体,可以由苯合成,具体合成路线如下:

(1)J的化学式为__________________ ;F的名称为__________________。
(2)B中官能团名称为____________________ 。
(3)I—J的反应类型为____________________ 。
(4)F -G的反应方程式为____________________ 。
(5)与I属于同种类型物质且苯环上有两个取代基的同分异构体有____种。符合下列条件的J的一种同分异构体结构简式为______。
①属于芳香族化合物 ②不能与金属钠反应 ③有3种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列几组物质中,互为同分异构体的有___________。
①O2和O3;②CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH(CH3)CH2C2H5;③丙烯和丁烯;④3-乙基己烷和辛烷;⑤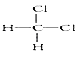 和
和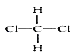
(2)用系统命名法给如图所示的有机物命名,其名称为_________________ 。
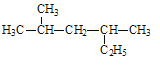
(3)甲烷在氯气中燃烧,可看到集气瓶内壁有黑色固体颗粒生成,瓶口产生大量白雾,据以上现象分析,上述反应的化学反应方程式为_______________________________。
(4)已知1g苯在氧气中完全燃烧放出的热量3.4 kJ,写出表示苯的燃烧热的热化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Zn +2 HCl = ZnCl2 + H2↑的反应中,氧化剂是_________,失去电子的是_________,化合价降低的元素是_________,氧化产物是_________,还原产物是_________,画出该反应的双线桥并标出电子转移的方向和数目:__________________
Zn + 2 HCl = ZnCl2 + H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com