
下列有关元素周期表和元素周期律的说法,错误的是
①元素周期表中s区、d区和ds区的元素都是金属元素
②d区元素最后一个核外电子一定填充在s能级上
③原子核外电子的能层越多,原子半径越大
④同一周期自左至右,元素的第一电离能依次增大
A.只有①②③ B.只有②③ C.只有③④ D.①②③④
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:选择题
关于“物质的量”叙述正确的是
A、单位:g.mol-1
B、七个基本物理量之一
C、用来描述微观粒子的质量
D、数值是:6.02×1023
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高一上学期期中化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.金属钠着火时,用细沙覆盖灭火
B.Na的化掌性质比镁活泼,故用Na与MgCl2溶液反应制取金属镁
C.金属钠与氧气反应,条件不同,产物不同
D.9.2g金属钠与足量水反应,反应过程中有0.4mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对
②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素
③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素
④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥AgCl是一种白色的沉淀,不溶于硝酸、浓硫酸、烧碱溶液,却能溶于氨水中
A、①③ B.②③ C.⑤⑥ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
某元素X的逐级电离能如下图所示,下列说法正确的是
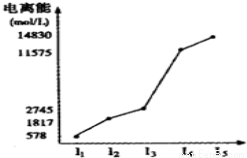
A.X元素可能为+4价
B.X为非金属
C.X为第五周期元素
D.X与氯反应时最可能生成的阳离子为X3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,则
A.原子半径:x>yB.电负性:x>yC.离子半径:x<yD.第一电离:x<y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高三上学期第一次月考化学试卷(解析版) 题型:选择题
25℃时,下列各溶液中有关物质的量浓度关系正确的是
A.常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:
c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.向NH4HSO4溶液中滴加含等物质的量溶质的NaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C.在0.1mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+c(SO42-)
D.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是
A.C元素的最高正价为+7价
B.原子半径:A>B>C
C.离子半径:A2->C->B2+
D.还原性:A2-<C-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A.D原子的简化电子排布式为[Ar]3s23p4
B.B、C两元素的第一电离能大小关系为B>C
C.用电子式表示AD2的形成过程为
D.由B60分子形成的晶体与A60相似,分子中总键能:B60 >A60
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com