
����Ŀ����ˮռ�����ܴ�ˮ����97.2%�����Ѻ�ˮ�����ͻ�����������������ȿ��Խ����ˮ��Դȱ�������⣬�ֿ��Գ�����ú�����Դ��
��1��Ŀǰ������ʵ�õġ���ˮ��������Ҫ����֮һ�����������ǽ���ˮ�������������������ȴ���øߴ��ȵ�ˮ���ɴ˿��ж�������____________________���������仯����ѧ�仯����
��2����ҵ�����õ�ⱥ��ʳ��ˮ���Ƶ���Ҫ������Ʒ���ֳ�Ϊ���ȼҵ������ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ___________________________________________��
��3��ʵ������MnO2��Ũ����Ϊԭ���Ʊ��������÷�Ӧ�Ļ�ѧ����ʽΪ_____________��β�������Ļ�ѧ����ʽΪ_______________________________________����ҵ���Ʊ�Ư�۵Ļ�ѧ����ʽ________________________________________��
��4����ʵ�����Ƶ�����������Ƶ���ˮ���ж����������û�ѧ����ʽ������������
�ٽ���ˮ�μ���ɫʯ����Һ�У��ȱ�����ɫ________________________________��
�ڽ���ˮ������������Һ�У��а�ɫ��������___________________________��
���𰸡� �����仯 2NaCl+2H2O![]() 2NaOH+H2��+Cl2�� MnO2+4HCl(Ũ)
2NaOH+H2��+Cl2�� MnO2+4HCl(Ũ)![]() MnCl2+2H2O+Cl2�� Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2+H2O=HCl+HCl HCl+AgNO3=AgCl��+HNO3
MnCl2+2H2O+Cl2�� Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2+H2O=HCl+HCl HCl+AgNO3=AgCl��+HNO3
����������1�����ݺ�ˮ�������������������ȴ���øߴ��ȵ�ˮ��֪û�����������ʣ��������������仯��
��2����ҵ�ϵ�ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��3��MnO2��Ũ�����ڼ��ȵ�������������������ѧ����ʽΪ��MnO2+4HCl(Ũ) ![]() MnCl2+2H2O+Cl2���������ж����������ŷţ���NaOH��Һ���գ���ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O����ҵ����ȡƯ������������ʯ����Ϊԭ�ϣ����ɵĴ������ΪƯ�۵���Ҫ�ɷ֣������Ļ�ѧ����ʽΪ��2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O��
MnCl2+2H2O+Cl2���������ж����������ŷţ���NaOH��Һ���գ���ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O����ҵ����ȡƯ������������ʯ����Ϊԭ�ϣ����ɵĴ������ΪƯ�۵���Ҫ�ɷ֣������Ļ�ѧ����ʽΪ��2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O��
��4����Cl2��ˮ��Ӧ�Ļ�ѧ����ʽΪ�� Cl2+H2O=HCl+HCl��������ˮ�к���HCl��HClO��HCl����ˮ�����ԣ�������ɫʯ���죬HClO����ǿ�����Ժ�Ư���ԣ�������ɫʯ���������ɫ������ˮ�к���HCl��������������Һ������Ӧ��HCl+AgNO3=AgCl��+HNO3�������а�ɫ�������ɡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������M�м��ۻ������أ���ṹ��ͼ��ʾ���������㶹������Ȼ�������M��������������ȷ���ǣ� �� 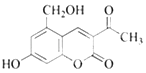
A.���������������ȵ������£�1molM������5molH2�����ӳɷ�Ӧ
B.M��ʹ����KMnO4��Һ��ɫ
C.M�����ȵ�NaOH��Һ�з�����Ӧ����������3molNaOH
D.1molM����3molBr2����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������1Lˮ�г�ֽ������Һ�����������������ǣ� ��
A.KCl
B.Mg��OH��2
C.Na2CO3
D.MgSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� �� ��
A. ��Ͳ��ȡ20.0mL 0.500 mol��L��1 H2SO4��Һ���ձ��У���80 mLˮ���Ƴ�0.100 mol��L��1H2SO4��Һ B. ��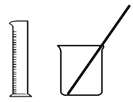 ����100 mL 0.100 0 mol��L��1 KMnO4��Һ
����100 mL 0.100 0 mol��L��1 KMnO4��Һ
C. �����������ƿ���ܽⲢϡ�����̶ȣ����Ƴ�һ�����ʵ���Ũ�ȵ���Һ D. 1 g 98%��Ũ�����4 gˮ���Ƴ�19.6%��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������ı��ӣ��ɲ��õ����˷����ǣ� ��
A.��70�����ϵ���ˮ����Һ
B.������Ũ��ˮ������
C.������NaOH��Һ����Һ
D.������FeCl3��Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ�п��ܴ������ڵ�һ���������� ��
A. H+��Cl����PO43����Na+ B. H+��Fe2+��SO42����NO3��
C. K+��H+��NO3����Na+ D. OH����Br����SO42����NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5L 1mol/L FeCl3��Һ��0.2L1mol/L KCl��Һ�е�Cl-����Ŀ֮��
A. 5��2 B. 3��1 C. 15��2 D. 1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�������ʣ������ӣ�������ͬһ��Ԫ�أ�����֮������ͼ��ʾ��ת����ϵ��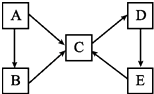
��1����AΪ���ʣ�C��D����Է����������16��0.05 molL��1 E��Һ��ֻ��3�����ӣ�����25��ʱ����Һ�е� ![]() =1012 �� ����BΪ��̬�⻯�д��E��C��һ����ѧ����ʽ ��
=1012 �� ����BΪ��̬�⻯�д��E��C��һ����ѧ����ʽ ��
����A��C�ķ�Ӧ�У�ÿת��1 mol e���ͻ����143.5 kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��2����AΪ���ʣ�B��C���������࣬D��һ�ְ�ɫ����������B��ˮ��Һ�����ԣ�C��ˮ��Һ�ʼ��ԣ�C��Һ�ʼ��Ե�ԭ�����������ӷ���ʽ��ʾ����
����B��Һ�ʻ�ɫ�������軯����Һ��Ϻ��Ժ�ɫ��E��һ�ֲ����Լ��
����B��C�����ӷ���ʽΪ ��
����D��E�Ļ�ѧ����ʽΪ ��
����ѡ��һ���Լ�R��E��Ӧʵ��E��C��ת������RΪ���÷�Ӧ�����ӷ���ʽΪ ��
��3����A��E��Ϊ������Ҿ�����Ԫ��Y��A�ǵ���ɫ���壬B��C����Һ�ڵ����ʵ���Ũ��ʱ��C��Һ��pH��С�����D��ˮ��Һ������Ҫ�Ĺ�ҵ����֮һ��D��E��CҲ�ǹ�ҵ�Ʊ�C���ձ鷽����Y�ĵ�����صĺϽ���ں˷�Ӧ���������Ƚ���Һ��5.05 g Y�غϽ�����200 mLˮ����0.075 mol���������㲢ȷ����Y�غϽ�Ļ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mLBaCl2��AlCl3��FeCl3 �Ļ����ҺA����μ���Na2SO4��NaOH�Ļ����ҺB���������������ʵ���n�ͼ�����ҺB�������ϵ��ͼ��ʾ�� 
��1��������110mLB��Һʱ����Һ�еij��������ѧʽ����
��2����ҺB��Na2SO4��NaOH�����ʵ���Ũ��֮���� �� ��B��Һ�ӵ�90mL��100mL��һ��ʱ���У������������ӷ�Ӧ����ʽ��
��3����A��B��Һ�и����ʵ����ʵ���Ũ�ȣ�c�������±��У�
���� | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c/molL��1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com