
【题目】四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③B.①②③④C.①②③D.②③
【答案】C
【解析】
四种短周期元素的离子![]() 具有相同的电子层结构,核外电子总数相等,则a-m=b-n=c+n=d+m,若m>n,故原子序数大小顺序是:a>b>c>d,根据阴阳离子可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,在同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的金属性随着原子序数的增大而减小,元素的金属性越强,其最高价氧化物的水化物碱性越强。
具有相同的电子层结构,核外电子总数相等,则a-m=b-n=c+n=d+m,若m>n,故原子序数大小顺序是:a>b>c>d,根据阴阳离子可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,在同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的金属性随着原子序数的增大而减小,元素的金属性越强,其最高价氧化物的水化物碱性越强。
四种短周期元素的离子![]() 具有相同的电子层结构,核外电子总数相等,则am=bn=c+n=d+m,若m>n,故原子序数大小顺序是a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,①离子aXm+、bYn+具有相同的电子层结构,则离子核外具有的相同的电子数,即am=bn,则ab=mn,①正确;
具有相同的电子层结构,核外电子总数相等,则am=bn=c+n=d+m,若m>n,故原子序数大小顺序是a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,①离子aXm+、bYn+具有相同的电子层结构,则离子核外具有的相同的电子数,即am=bn,则ab=mn,①正确;
②由题意可知,具有相同的电子层结构,根据阴前阳后,X、Y在下一周期,Z、R在上一周期,若m>n,则Y在X的前面,R在Z的前面,所以元素的原子序数为a>b>c>d,②正确;
③Z、R为同一周期非金属元素,在同一周期从左向右非金属性逐渐增强,则非金属性:Z>R,③正确;
④四种主族元素中X、Y为下一周期的金属元素,且元素的原子序数a>b,在同一周期元素的金属性从左向右在减弱,即金属性Y>X,则最高价氧化物对应水化物碱性Y>X,④错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,五种阴离子为
,五种阴离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现将它们分别配成
现将它们分别配成![]() 的溶液,进行如下实验
的溶液,进行如下实验
![]() 测得溶液A、B呈碱性,且碱性为
测得溶液A、B呈碱性,且碱性为![]() ;
;
![]() 向C溶液中滴加稀盐酸,有气体生成;
向C溶液中滴加稀盐酸,有气体生成;
![]() 向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
请根据上述实验现象,回答下列问题
![]() 实验
实验![]() 中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
![]() 分两步写出实验
分两步写出实验![]() 中发生反应的离子方程式______________。
中发生反应的离子方程式______________。
![]() 写出下列四种化合物的化学式:A______________;B______________。
写出下列四种化合物的化学式:A______________;B______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH均为2的盐酸、硫酸、醋酸三瓶溶液
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是________________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是___________________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应过程中放出H2的速率依次为a1、a2、a3,则其关系是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都与氢原子结合。
(1)图中属于烷烃的是______ (填字母)。
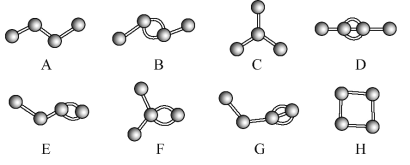
(2) 上图中互为同分异构体的是A与____;B与_____;D与____(填字母)。
Ⅱ、等物质的量的乙烯与甲烷,所含分子数之比_____,碳原子个数之比为_____,若充分燃烧,消耗O2的体积比为______;0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.所有的硅酸盐都难溶于水,可用带玻璃塞的玻璃瓶盛放
B.SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应
C.SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强
D.石灰石是工业制备普通玻璃和水泥的共同原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用______________量取10.00 mL 1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为______________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录______________;
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应______________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:______________。
⑵本实验中应选用______________(填序号)的量筒。
A、100 mL B、200 mL C、500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=______________。
⑷简述速率不等的原因______________铜丝不与酸接触的原因______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示:

已知A、D、E、F是中学化学中常见的单质,B、C是氧化物,且B的式量是232。请填空:
(1)A是______________,E是______________。(填化学式)
⑵D跟水反应的化学方程式为______________。
⑶C电解时,每生成1 molA,同时生成______________mol E。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写)__________→________→________→ D→________。
(2)D步骤中液面应调节到______________,尖嘴部分应______________。
(3)滴定终点时锥形瓶中颜色变化是______________。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”、“低”或“不变”)
(5)该烧碱样品纯度的计算式为______________。
Ⅱ. (1)常温下,0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则①混合溶液中由水电离出的c(H+)___(填“>”、“<”或“=”)HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。
c(Cl-)-c(M+)=________ mol/L;c(H+)-c(MOH)=________ mol/L。
(2)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________(填“>7”或“<7”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯的发生装置如图所示。下列说法正确的是

A.烧瓶中加入乙醇、浓硫酸和碎瓷片
B.反应温度控制在140℃
C.导出的气体中只有乙烯
D.可用向上排气法收集乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com