
【题目】现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,五种阴离子为
,五种阴离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现将它们分别配成
现将它们分别配成![]() 的溶液,进行如下实验
的溶液,进行如下实验
![]() 测得溶液A、B呈碱性,且碱性为
测得溶液A、B呈碱性,且碱性为![]() ;
;
![]() 向C溶液中滴加稀盐酸,有气体生成;
向C溶液中滴加稀盐酸,有气体生成;
![]() 向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
请根据上述实验现象,回答下列问题
![]() 实验
实验![]() 中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
![]() 分两步写出实验
分两步写出实验![]() 中发生反应的离子方程式______________。
中发生反应的离子方程式______________。
![]() 写出下列四种化合物的化学式:A______________;B______________。
写出下列四种化合物的化学式:A______________;B______________。
【答案】![]() ; 先出现白色沉淀,迅速变为灰绿色,最终变为红褐色
; 先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 ![]() ↓、
↓、![]()
![]()
![]()
【解析】
根据题意,现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为K+、Ca2+、Ba2+、Fe2+、Al3+,五种阴离子为Cl-、OH-、NO3-、SO42、CO32,现将它们分别配成0.5 mol·L-1的溶液,进行如下实验,测得溶液A、B呈碱性,分析得出溶液显碱性的只能是含OH-的碱和易溶于水的碳酸盐,由于CO32与Ca2+、Ba2+、Fe2+、Al3+不共存,所以碳酸盐只能是碳酸钾,碱只能为氢氧化钡,由于碱性B>A,所以A为K2CO3,B为Ba(OH)2;向C溶液中滴加稀盐酸,有气体生成,不可能是碳酸盐了,那就要思考其他情况,分析得出会发生氧化还原反应而得到NO气体,发生9Fe(NO3)2+12HCl =5Fe(NO3)3+3NO↑+4FeCl3+6H2O反应,说明C物质为Fe(NO3)2,向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失,说明溶液中含有Al3+,结合前面离子分析,D物质为Al2(SO4)3溶液。
⑴向C溶液中滴加稀盐酸,发生反应9Fe(NO3)2+12HCl = 5Fe(NO3)3+3NO↑+4FeCl3+6H2O。向Fe(NO3)2溶液中加入NaOH溶液,先是亚铁离子和氢氧根反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化,迅速变灰绿色,最终变为红褐色,故答案为:9Fe(NO3)2+12HCl = 5Fe(NO3)3+3NO↑+4FeCl3+6H2O,先出现白色沉淀,迅速变为灰绿色,最终变为红褐色;
⑵D为Al2(SO4)3溶液,向Al2(SO4)3溶液中滴加NaOH溶液,Al3+先与OH-反应生成氢氧化铝白色沉淀即Al3++3OH-= Al(OH)3↓,再滴加氢氧化钠溶液,白色沉淀又消失即发生离子反应Al(OH)3+OH-= AlO2-+2H2O,故第一空答案Al3++3OH-= Al(OH)3↓,第二空答案Al(OH)3+OH-= AlO2-+2H2O;
⑶由上面的分析可知,A为碳酸钾,B为氢氧化钡;故第一空答案为K2CO3,第二空答案为Ba(OH)2。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
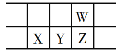
A.原子半径:W<X
B.Y单质是良好的半导体材料
C.气态氢化物热稳定性:W>Z
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
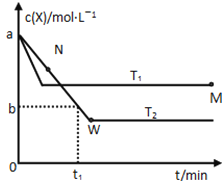
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.0.1 mol 的11B中,所含中子数为0.6NA
B.标准状况下,22.4 L CCl4中所含氯原子数为4NA
C.1.0 mol CH4与1.0 molCl2在光照下反应生成的CH3Cl分子数为1.0NA
D.常温常压下,124 g P4中所含P—P键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:![]()
化学键 |
|
|
|
|
| a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的![]() ______
______![]() 用含a、b、c、d的代数式表示
用含a、b、c、d的代数式表示![]() 。
。

![]() 温度时,向1L的恒容反应器中充入2
温度时,向1L的恒容反应器中充入2![]() ,仅发生上述反应,反应过程中
,仅发生上述反应,反应过程中![]() min
min![]() 的物质的量随时间变化如图1,测得
的物质的量随时间变化如图1,测得![]() min时
min时![]() 的浓度为
的浓度为![]()
![]() min内
min内![]() 表示的反应速率为______
表示的反应速率为______![]()
![]()
![]() 若图1中曲线a、曲线b分别表示在温度
若图1中曲线a、曲线b分别表示在温度![]() 时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n
时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n![]() 的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a“或“b”)。
的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a“或“b”)。
![]() min时,若改变外界反应条件,导致
min时,若改变外界反应条件,导致![]() 发生图中所示变化,则改变的条件可能是_______
发生图中所示变化,则改变的条件可能是_______![]() 任答一条即可
任答一条即可![]() 。
。
![]() 实验测得:
实验测得:![]() ,
,![]() ,其中
,其中![]() 、
、![]() 为速率常数仅与温度有关,
为速率常数仅与温度有关,![]() 温度时
温度时![]() 与
与![]() 的比值为______(填数值)。若将温度由
的比值为______(填数值)。若将温度由![]() 升高到
升高到![]() ,则反应速率增大的倍数
,则反应速率增大的倍数![]() ______V逆 (选填“
______V逆 (选填“![]() ”、“
”、“![]() ”或“<”)。
”或“<”)。
![]() 科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了
科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了![]() 与
与![]() 的固体,可在高温下传导
的固体,可在高温下传导![]()
![]() 极为______极(选填“阳”或“阴”)。
极为______极(选填“阳”或“阴”)。
![]() 该电池工作时负极反应方程式为________。
该电池工作时负极反应方程式为________。
![]() 用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为11.2L,则透过阳离子交换膜的离子的物质的量为_________ mol
用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为11.2L,则透过阳离子交换膜的离子的物质的量为_________ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________,B接__________。
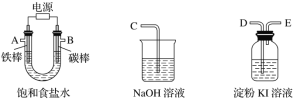
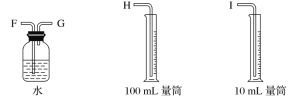
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______________________。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象: __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。
(1)饱和食盐水所用的原料粗盐主要来自于海洋,从海水中得到粗盐我们通常用的方法是_______。
(2)所得的粗盐(含Ca2+、Mg2+、SO42-)需要提纯,需要加入足量NaOH、BaCl2、Na2CO3溶液将杂质离子除去,随后过滤并加入盐酸调pH至7。其中先用BaCl2,再用Na2CO3的原因是______。
(3)饱和食盐水除用于制纯碱,也是氯碱工业的原料。氯碱工业中电解饱和食盐水的方程式为_______。
(4)测试纯碱产品中NaHCO3含量的方法是:用_______(定量仪器)称取纯碱样品1.144g,用蒸馏水溶解,加入0.500mol/L的HCl溶液100mL,再加1-2滴酚酞,继续用0.500mol/L标准氢氧化钠溶液滴定。当滴定至溶液由_____色变_____色,半分钟不变色为滴定终点。
(5)若上述过程中共消耗氢氧化钠58.00mL,纯碱样品中NaHCO3质量分数为_____。(保留3位小数)
(6)如果装氢氧化钠的滴定管滴定结束读数时有漏液情况,会导致测定结果______(选填“偏大”、“偏 小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、钢铁中加入少量镍铬等元素可制成不锈钢,东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是______________________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_________,提供孤电子对的成键原子是________。
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因______________________________。
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有____________________;
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82+8H2O=2MnO4+10SO42+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:________________。
(5)已知H2S2O8的结构如图:
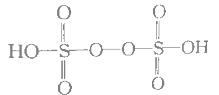
①H2S2O8硫原子的轨道杂化方式为________________。
②上述反应每生成2 mol MnO4,S2O82断裂的共价键数目为_________。
③上述反应中被还原的元素为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com