
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________,B接__________。
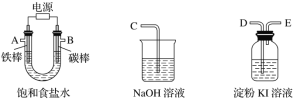
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______________________。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象: __________。
【答案】A接GFI B接DEC 负极 2Cl--2e-=Cl2↑ 淀粉KI溶液变蓝 12 白色沉淀迅速变成灰绿色最后变成红褐色
【解析】
U形管装置为电解装置,铁棒为阴极,连接电源负极,发生还原反应:2H++2e-=H2↑;碳棒为阳极,连接电源正极,发生氧化反应:2Cl--2e-=Cl2↑,所以从A出来的是H2,应该连接G,然后F连接I。淀粉KI溶液可以检验Cl2,所以B连接D,E连接C,目的是吸收尾气Cl2。
(1)根据以上分析可知:A接GFI ,B接DEC ;
答案: A接GFI B接DEC
(2)铁棒不可连接电源正极,如果连接正极铁会失电子,发生氧化反应,所以必须连接电源负极;碳棒为阳极,连接电源正极,发生氧化反应:2Cl--2e-=Cl2↑;
答案:负极 2Cl--2e-=Cl2↑
(3)利用Cl2+2KI=2KCl+I2,碘单质使得淀粉溶液变蓝,证明氯气具有氧化性;
答案:淀粉KI溶液变蓝
(4)2NaCl+2H2O![]() 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
2mol 22.4L
n(NaOH) 5.6×10-3L
n(NaOH)=![]() mol=0.0005mol
mol=0.0005mol
c(NaOH)=![]() =
=![]() =0.01mol/L
=0.01mol/L
pH=-lg![]() =-lg
=-lg![]() =12
=12
答案:12
(5)若将B电极换成铁电极,总电极反应为Fe+2H2O![]() Fe(OH)2↓+H2↑,后续反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此现象为生成白色沉淀,迅速变成灰绿色最后变成红褐色。
Fe(OH)2↓+H2↑,后续反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此现象为生成白色沉淀,迅速变成灰绿色最后变成红褐色。
答案:白色沉淀迅速变成灰绿色最后变成红褐色


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】某研究小组用工业生产高锰酸钾产生的废渣——锰泥(含![]() 、
、![]() 及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(
及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(![]() ),其流程如下:
),其流程如下:
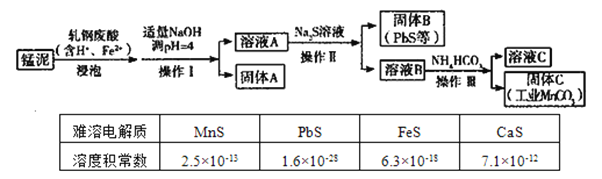
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ的名称是____。
(2)轧钢废酸中![]() 的作用是_________________。
的作用是_________________。
(3)固体A是_____________。(填化学式,下同)
(4)溶液B中含有____阳离子,通过表格中数据简单说明固体B与以上离子分离的原因_____。
(5)若固体C中不含![]() ,则溶液C中
,则溶液C中![]() __。(已知:
__。(已知:![]()
![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
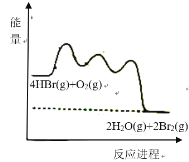
【题目】HBr被![]() 氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
Ⅰ.HBr(g)+O2(g)=HOOBr(g);
Ⅱ.HOOBr(g)+HBr(g)=2HOBr(g);
Ⅲ.HOBr(g)+HBr(g)=H2O(g)+Br2(g)
1mol HBr(g)被氧化为![]() (g)放出
(g)放出![]() 热量,其能量与反应进程的关系如图所示:
热量,其能量与反应进程的关系如图所示:
下列说法正确的是![]()
![]()
A.反应Ⅰ、Ⅱ、Ⅲ均为放热反应
B.Ⅰ的反应速率最慢
C.HOOBr比HBr和![]() 稳定
稳定
D.热化学方程式为:4HBr(g)+O2(g)=2H2O(g)+2Br2(g) ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() 引起了全世界的普遍重视。目前工业上有一种方法是用
引起了全世界的普遍重视。目前工业上有一种方法是用![]() 来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入
来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入![]() 和
和![]() ,在
,在![]() 下发生发应
下发生发应![]() 实验测得
实验测得![]() 和
和![]() 的物质的量
的物质的量![]() 随时间变化如图1所示:
随时间变化如图1所示:
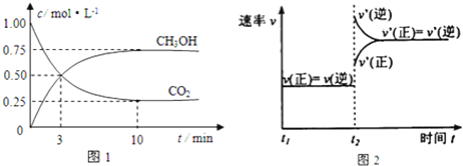
(1)下列事实能说明反应到达平衡状态的是______________
A.容器内的密度不再改变 B. CO2和H2 的物质的量比不再改变
C.v正(CO2)=3v逆(H2) D. 容器内的压强不再改变
(2)![]() 达平衡时,
达平衡时,![]() 的体积分数为____________,平衡常数为______
的体积分数为____________,平衡常数为______![]() 保留两位小数
保留两位小数![]() ;该温度下,测得某时刻,
;该温度下,测得某时刻,![]() 、
、![]() 、
、![]() 和
和![]() 的浓度均
的浓度均![]() ,则此 时
,则此 时![]() 正
正![]() ______
______![]() 逆
逆![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)由图2可知,当温度升高到![]() 达平衡时,K值__________
达平衡时,K值__________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。
。
(4)下列措施中不能使![]() 的转化率增大的是______。
的转化率增大的是______。
A.在原容器中再充入1mol![]()
B.在原容器中再充入![]()
C.缩小容器的容积
![]() 使用更有效的催化剂
使用更有效的催化剂
E.将水蒸气从体系中分离出
F.在原容器中充入1molHe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,五种阴离子为
,五种阴离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现将它们分别配成
现将它们分别配成![]() 的溶液,进行如下实验
的溶液,进行如下实验
![]() 测得溶液A、B呈碱性,且碱性为
测得溶液A、B呈碱性,且碱性为![]() ;
;
![]() 向C溶液中滴加稀盐酸,有气体生成;
向C溶液中滴加稀盐酸,有气体生成;
![]() 向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
请根据上述实验现象,回答下列问题
![]() 实验
实验![]() 中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
![]() 分两步写出实验
分两步写出实验![]() 中发生反应的离子方程式______________。
中发生反应的离子方程式______________。
![]() 写出下列四种化合物的化学式:A______________;B______________。
写出下列四种化合物的化学式:A______________;B______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是工业上主要用作有机合成的原料和溶剂,可由最简单芳香烃A经如下流程制得:
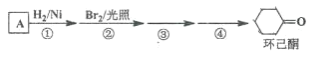
回答下列问题:
(1)反应①的反应类型为_______反应,反应③的反应类型为______。
(2)反应④所用的试剂为_______。
(3)A的同系物(C8H10)所有可能的结构简式为_______。
(4)环己酮的还原产物能与乙酸产生乙酸酯,请写出产生酯的条件。_______
(5)写出A的相邻同系物合成![]() 的合成路线。合成路线常用的表示方式为:______
的合成路线。合成路线常用的表示方式为:______
A![]() B……
B……![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用下图所示的实验装置来制备纯净、干燥的氯气,并实验其与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
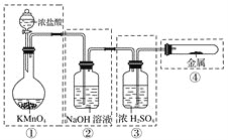
A.①和②处B.只有②处
C.②和③处D.②、③、④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用______________量取10.00 mL 1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为______________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录______________;
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应______________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:______________。
⑵本实验中应选用______________(填序号)的量筒。
A、100 mL B、200 mL C、500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=______________。
⑷简述速率不等的原因______________铜丝不与酸接触的原因______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com