
【题目】环己酮是工业上主要用作有机合成的原料和溶剂,可由最简单芳香烃A经如下流程制得:
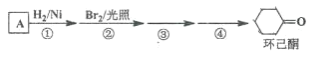
回答下列问题:
(1)反应①的反应类型为_______反应,反应③的反应类型为______。
(2)反应④所用的试剂为_______。
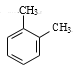
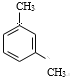
(3)A的同系物(C8H10)所有可能的结构简式为_______。
(4)环己酮的还原产物能与乙酸产生乙酸酯,请写出产生酯的条件。_______
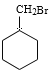
(5)写出A的相邻同系物合成![]() 的合成路线。合成路线常用的表示方式为:______
的合成路线。合成路线常用的表示方式为:______
A![]() B……
B……![]() 目标产物
目标产物
【答案】加成 取代 铜或银作催化剂,O2  、
、 、
、 、
、![]() 浓硫酸、加热
浓硫酸、加热 ![]()
![]()
![]()
![]()
![]()
【解析】
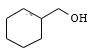
苯与H2在Ni作催化剂、加热反应产生环己烷![]() ,
,![]() 与Br2在光照时发生取代反应产生
与Br2在光照时发生取代反应产生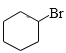 ,
, 与NaOH的水溶液发生取代反应产生
与NaOH的水溶液发生取代反应产生![]() ,
,![]() 在Cu作催化剂、加热时,被O2氧化产生环己酮。
在Cu作催化剂、加热时,被O2氧化产生环己酮。
(1)![]() 与H2在Ni作催化剂、加热反应产生环己烷
与H2在Ni作催化剂、加热反应产生环己烷![]() ,故反应①类型为加成反应,反应③是
,故反应①类型为加成反应,反应③是 中的Br原子被-OH取代产生
中的Br原子被-OH取代产生![]() ,故该反应类型为取代反应;
,故该反应类型为取代反应;
(2)反应④是![]() 在Cu作催化剂、加热时,被O2氧化产生环己酮,故所用的试剂为铜或银作催化剂,O2作反应物,发生催化氧化反应;
在Cu作催化剂、加热时,被O2氧化产生环己酮,故所用的试剂为铜或银作催化剂,O2作反应物,发生催化氧化反应;
(3)A的同系物(C8H10)可能是乙苯,也可能是二甲苯,两个甲基在苯环上可能位于邻位、间位、对位,故所有可能的结构简式为 、
、 、
、 、
、![]() ;
;
(4)环己酮的还原产物是环己醇![]() ,该物质含有醇羟基,能与乙酸在浓硫酸存在和加热时发生酯化反应产生乙酸环己酯,则反应产生酯的条件是浓硫酸、加热;
,该物质含有醇羟基,能与乙酸在浓硫酸存在和加热时发生酯化反应产生乙酸环己酯,则反应产生酯的条件是浓硫酸、加热;
(5) A的相邻同系物是甲苯,以甲苯为原料合成![]() ,首先是催化加氢还原产生
,首先是催化加氢还原产生![]() ,然后
,然后![]() 与Br2在光照时发生取代反应产生
与Br2在光照时发生取代反应产生 ,
, 与NaOH的水溶液共热,发生取代反应产生
与NaOH的水溶液共热,发生取代反应产生 。故合成路线表示为:
。故合成路线表示为:![]()
![]()
![]()
![]()

![]()
 。
。


科目:高中化学 来源: 题型:
【题目】有4种碳骨架如下的烃。下列说法正确的是( )
![]()
①a和d是同分异构体 ②b和c是同系物 ③a和d都能发生加聚反应 ④只有b和c能发生取代反应
A. ①② B. ①④
C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.0.1 mol 的11B中,所含中子数为0.6NA
B.标准状况下,22.4 L CCl4中所含氯原子数为4NA
C.1.0 mol CH4与1.0 molCl2在光照下反应生成的CH3Cl分子数为1.0NA
D.常温常压下,124 g P4中所含P—P键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________,B接__________。
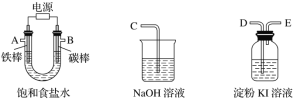
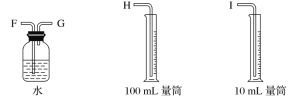
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______________________。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象: __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。
(1)饱和食盐水所用的原料粗盐主要来自于海洋,从海水中得到粗盐我们通常用的方法是_______。
(2)所得的粗盐(含Ca2+、Mg2+、SO42-)需要提纯,需要加入足量NaOH、BaCl2、Na2CO3溶液将杂质离子除去,随后过滤并加入盐酸调pH至7。其中先用BaCl2,再用Na2CO3的原因是______。
(3)饱和食盐水除用于制纯碱,也是氯碱工业的原料。氯碱工业中电解饱和食盐水的方程式为_______。
(4)测试纯碱产品中NaHCO3含量的方法是:用_______(定量仪器)称取纯碱样品1.144g,用蒸馏水溶解,加入0.500mol/L的HCl溶液100mL,再加1-2滴酚酞,继续用0.500mol/L标准氢氧化钠溶液滴定。当滴定至溶液由_____色变_____色,半分钟不变色为滴定终点。
(5)若上述过程中共消耗氢氧化钠58.00mL,纯碱样品中NaHCO3质量分数为_____。(保留3位小数)
(6)如果装氢氧化钠的滴定管滴定结束读数时有漏液情况,会导致测定结果______(选填“偏大”、“偏 小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出七种元素的相关信息,根据以下信息填空:
元素 | 相关信息 |
A | 核外电子数和电子层数相等 |
B | 基态原子2p能级有3个未成对电子 |
C | 在地壳中含量最高 |
D | 目前,在元素周期表中电负性最大 |
E | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
F | 原子序数等于D与E的原子序数之和 |
G | 基态原子2p能级上有两个空轨道 |
(1)写出D在元素周期表中的位置___________________。
(2)14gB的单质分子中π键的个数为____________。
(3)C元素的氢化物的沸点是同族元素氢化物中最高的,原因是________。
(4)B、C、D 3种元素的电负性由大到小的顺序为________(用元素符号表示)。
(5)写出一种与B2互为等电子体的分子或离子____________。
(6)已知BA5为离子化合物,写出其电子式:_______。
(7)第二周期中,第一电离能介于B元素和G 元素间的元素为 ____(填“元素符号”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、钢铁中加入少量镍铬等元素可制成不锈钢,东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是______________________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_________,提供孤电子对的成键原子是________。
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因______________________________。
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有____________________;
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82+8H2O=2MnO4+10SO42+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:________________。
(5)已知H2S2O8的结构如图:
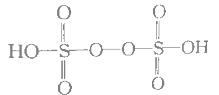
①H2S2O8硫原子的轨道杂化方式为________________。
②上述反应每生成2 mol MnO4,S2O82断裂的共价键数目为_________。
③上述反应中被还原的元素为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经过如图所示的过程转化为含氧酸D。已知D为强酸,请回答下列问题:
![]()
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___。
②在工业生产中气体B大量排放后,被雨水吸收形成了污染环境的___。
(2)A在常温下为气体,C是红棕色的气体。
①A的化学式是___;C的化学式是___。
②在常温下D的浓溶液可与铜反应并生成气体C,请写出该反应的化学方程式:___,该反应__(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色固体物质A有如下图所示的转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
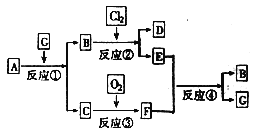
⑴写出B和C的化学式:B______________;C______________。
⑵写出反应④的离子方程式______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com