
【题目】黑色固体物质A有如下图所示的转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
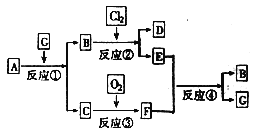
⑴写出B和C的化学式:B______________;C______________。
⑵写出反应④的离子方程式______________
【答案】FeSO4 H2S 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
【解析】
从框图中可以看出,反应②是解题的突破口。因为它的已知信息多,不仅有“D、E有共同的阳离子”,而且有Cl2这种具有强氧化性的特殊物质。
(1)由反应②知,B物质具有还原性;由反应④知,E物质具有氧化性,F气体具有还原性。综合分析反应②和④,可得出B中的阳离子具有还原性,从而得出其为亚铁盐。结合反应③,可得出F气体为SO2,C气体为H2S。再回到反应④,F为SO2,氧化产物必然为H2SO4,从而得出E为Fe2(SO4)3、B为FeSO4、G为H2SO4。由反应①,很容易得出A为FeS。由反应②,可得出D为FeCl3。答案为:B是FeSO4、C是H2S。
(2) 反应④的化学方程式为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】环己酮是工业上主要用作有机合成的原料和溶剂,可由最简单芳香烃A经如下流程制得:
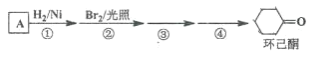
回答下列问题:
(1)反应①的反应类型为_______反应,反应③的反应类型为______。
(2)反应④所用的试剂为_______。
(3)A的同系物(C8H10)所有可能的结构简式为_______。
(4)环己酮的还原产物能与乙酸产生乙酸酯,请写出产生酯的条件。_______
(5)写出A的相邻同系物合成![]() 的合成路线。合成路线常用的表示方式为:______
的合成路线。合成路线常用的表示方式为:______
A![]() B……
B……![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都与氢原子结合。
(1)图中属于烷烃的是______ (填字母)。
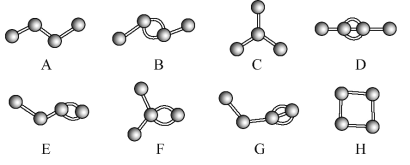
(2) 上图中互为同分异构体的是A与____;B与_____;D与____(填字母)。
Ⅱ、等物质的量的乙烯与甲烷,所含分子数之比_____,碳原子个数之比为_____,若充分燃烧,消耗O2的体积比为______;0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用______________量取10.00 mL 1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为______________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录______________;
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应______________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:______________。
⑵本实验中应选用______________(填序号)的量筒。
A、100 mL B、200 mL C、500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=______________。
⑷简述速率不等的原因______________铜丝不与酸接触的原因______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示:

已知A、D、E、F是中学化学中常见的单质,B、C是氧化物,且B的式量是232。请填空:
(1)A是______________,E是______________。(填化学式)
⑵D跟水反应的化学方程式为______________。
⑶C电解时,每生成1 molA,同时生成______________mol E。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据下图所示,回答下列问题:

(1)X的化学式为____________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为______________________。
(3)已知SO3是一种酸性氧化物,则SO3与NaOH溶液反应的离子方程式为__________________________________。
(4)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_______(填序号)。
A.Na2S+S B.Na2SO3+S C.Na2SO3+Na2SO4 D.SO2+Na2SO4
(5)将X与Y混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为_____。
Ⅱ.如图所示:图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
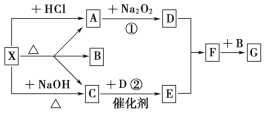
(1)物质X可以是_____________,C是______,F是_______。
(2)反应①的化学方程式是________________________________________。反应②的化学方程式是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写)__________→________→________→ D→________。
(2)D步骤中液面应调节到______________,尖嘴部分应______________。
(3)滴定终点时锥形瓶中颜色变化是______________。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”、“低”或“不变”)
(5)该烧碱样品纯度的计算式为______________。
Ⅱ. (1)常温下,0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则①混合溶液中由水电离出的c(H+)___(填“>”、“<”或“=”)HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。
c(Cl-)-c(M+)=________ mol/L;c(H+)-c(MOH)=________ mol/L。
(2)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________(填“>7”或“<7”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2L甲烷、乙烷、HCHO(g)组成的混合气体,完全燃烧后生成15.68LCO2(气体体积均在标准状况下测定),混合气体中甲烷的体积分数可能为
A. 40%B. 60%C. 70%D. 80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com