
【题目】Ⅰ、如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都与氢原子结合。
(1)图中属于烷烃的是______ (填字母)。
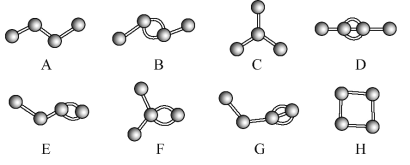
(2) 上图中互为同分异构体的是A与____;B与_____;D与____(填字母)。
Ⅱ、等物质的量的乙烯与甲烷,所含分子数之比_____,碳原子个数之比为_____,若充分燃烧,消耗O2的体积比为______;0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为______。
【答案】A、C C E、F、H G 1∶1 2∶1 3∶2 C6H12
【解析】
Ⅰ.小球表示碳原子,小棍表示化学键,每个C形成4个键,碳原子上其余的化学键都与氢原子结合,根据烷烃的概念和同分异构体分析解答;
Ⅱ.根据N=nNA可知,等物质的量的乙烯与甲烷,所含分子数相等,每个乙烯分子含有2个C原子、4个H原子,而每个甲烷分子含有1个C原子、4个H原子,据此计算碳原子数目之比;根据1molCxHy的耗氧量为(x+![]() )mol,计算二者耗氧量之比;根据原子守恒计算烃的分子式。
)mol,计算二者耗氧量之比;根据原子守恒计算烃的分子式。
Ⅰ.小球表示碳原子,小棍表示化学键,每个C形成4个键,碳原子上其余的化学键都与氢原子结合。
(1)烷烃分子中的碳碳键只有单键,且为链状结构,根据图示,只有A、C中含碳碳单键,为饱和链状结构,属于烷烃的是A、C,故答案为:A、C;
(2)同分异构体的分子式相同,但结构不同,A与C;B与E、F、H;D与G的分子式相同,结构不同,互为同分异构体,故答案为:C;E、F、H; G;
Ⅱ.根据N=nNA可知,等物质的量的乙烯与甲烷,所含分子数之比为1∶1,每个乙烯分子含有2个C原子、4个H原子,而每个甲烷分子含有1个C原子、4个H原子,可知碳原子数目之比为2∶1;1mol乙烯耗氧量为(2+![]() )mol=3mol,1mol甲烷耗氧量为(1+
)mol=3mol,1mol甲烷耗氧量为(1+![]() )mol =2mol,故等物质的量的乙烯与甲烷充分燃烧耗氧量之比为3mol∶2mol =3∶2;0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃分子中N(C)=
)mol =2mol,故等物质的量的乙烯与甲烷充分燃烧耗氧量之比为3mol∶2mol =3∶2;0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃分子中N(C)=![]() =6、N(H)=
=6、N(H)=![]() =12,故该烃的分子式为C6H12,故答案为:1∶1;2∶1;3∶2;C6H12。
=12,故该烃的分子式为C6H12,故答案为:1∶1;2∶1;3∶2;C6H12。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.0.1 mol 的11B中,所含中子数为0.6NA
B.标准状况下,22.4 L CCl4中所含氯原子数为4NA
C.1.0 mol CH4与1.0 molCl2在光照下反应生成的CH3Cl分子数为1.0NA
D.常温常压下,124 g P4中所含P—P键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、钢铁中加入少量镍铬等元素可制成不锈钢,东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是______________________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_________,提供孤电子对的成键原子是________。
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因______________________________。
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有____________________;
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82+8H2O=2MnO4+10SO42+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:________________。
(5)已知H2S2O8的结构如图:
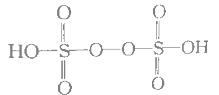
①H2S2O8硫原子的轨道杂化方式为________________。
②上述反应每生成2 mol MnO4,S2O82断裂的共价键数目为_________。
③上述反应中被还原的元素为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经过如图所示的过程转化为含氧酸D。已知D为强酸,请回答下列问题:
![]()
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___。
②在工业生产中气体B大量排放后,被雨水吸收形成了污染环境的___。
(2)A在常温下为气体,C是红棕色的气体。
①A的化学式是___;C的化学式是___。
②在常温下D的浓溶液可与铜反应并生成气体C,请写出该反应的化学方程式:___,该反应__(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如下图所示,下列说法正确的是
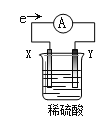
A.外电路的电流方向为:X→外电路→Y
B.X极上发生的是还原反应
C.溶液中氢离子向X极移动
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3。已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答:
(1)X元素的名称:X____,Y元素在元素周期表中的位置____,Z元素的原子结构示意图_______。
(2)用电子式表示ZX2的形成过程_____。
(3)Y2X对应水化物的电子式_____,其中存在的化学键有_____。
(4)写出Y2X溶于水的溶液与ZX2反应的化学方程式_______。
(5)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色固体物质A有如下图所示的转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
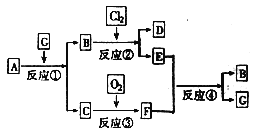
⑴写出B和C的化学式:B______________;C______________。
⑵写出反应④的离子方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图,
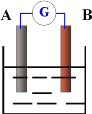
(1)若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为_________,写出正极的电极反应式______________;
(2)若A为铜片,B为银片,电解质为AgNO3溶液,则银片为______________极(填正或负),写出电极反应式:负极______________,正极______________
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,该燃料电池的总反应为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com