
【题目】I、钢铁中加入少量镍铬等元素可制成不锈钢,东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是______________________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_________,提供孤电子对的成键原子是________。
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因______________________________。
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有____________________;
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82+8H2O=2MnO4+10SO42+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:________________。
(5)已知H2S2O8的结构如图:
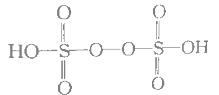
①H2S2O8硫原子的轨道杂化方式为________________。
②上述反应每生成2 mol MnO4,S2O82断裂的共价键数目为_________。
③上述反应中被还原的元素为________________。
【答案】正四面体型 配位键 N Fe2+的价电子排布式为 3d6 ,3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构能量较低,较稳定,所以Fe2+容易失去一个电子,易被氧化为Fe3+ (答到半充满的结构,较稳定算对)。 abc 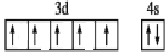 sp3杂化 5NA S
sp3杂化 5NA S
【解析】
(1)①根据价层电子对互斥理论分析SO42-的空间构型。
②[Ni(NH3)6]2+为一种配离子,Ni2+与NH3之间以配位键成键,NH3中的N原子提供孤电子对。
(2)根据Fe2+的价电子排布式为3d6分析解答。
(3)Fe4[Fe(CN)6]3是一种配合物,根据配合物的结构特点可知,该配合物中含有共价键、配位键、离子键。
(4)根据Mn的原子序数为25来解答。
(5)①H2S2O8中S原子形成4个σ键,S上无孤电子对,S的价层电子对数为4,采取sp3杂化。
②由反应可知,则每生成2mol MnO4,消耗S2O82为5mol,反应中S2O82中过氧键发生断裂生成SO42,故S2O82断裂的共价键数目为5NA。
③由反应可知,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),被还原的元素为S。
(1)①SO42-中的中心原子S的价层电子对数为4+![]() ×(6+2-4×2)=4,S上没有孤电子对,SO42-的空间构型为正四面体型,故答案为:正四面体型。
×(6+2-4×2)=4,S上没有孤电子对,SO42-的空间构型为正四面体型,故答案为:正四面体型。
②[Ni(NH3)6]2+为一种配离子,Ni2+与NH3之间以配位键成键,NH3中的N原子提供孤电子对,故答案为:配位键; N。
(2)Fe2+的价电子排布式为3d6 ,3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构能量较低,较稳定,所以Fe2+容易失去一个电子,易被氧化为Fe3+,故答案为:Fe2+的价电子排布式为3d6 ,3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构能量较低,较稳定,所以Fe2+容易失去一个电子,易被氧化为Fe3+。
(3)Fe4[Fe(CN)6]3是一种配合物,根据配合物的结构特点可知,Fe3+与[Fe(CN)6]4-间为离子键,[Fe(CN)6]4-内Fe2+与CN-间为配位键,CN-内含共价键,故选abc。
(4)Mn的原子序数为25,基态锰原子的价电子排布的轨道表示式: ,故答案为:
,故答案为: 。
。
(5)①H2S2O8中S原子形成4个σ键,S上无孤电子对,S的价层电子对数为4,采取sp3杂化。故答案为:sp3杂化。
②由反应可知,则每生成2mol MnO4,消耗S2O82为5mol,反应中S2O82中过氧键发生断裂生成SO42,故S2O82断裂的共价键数目为5NA,故答案为:5NA。
③由反应可知,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),被还原的元素为S,故答案为:S。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 丙烯的结构简式为CH2CHCH3
B. 新戊烷的二氯代物有2种
C. 分子式为CH4O和C2H6O的物质一定互为同系物
D. 键线式为 的有机物的分子式为C8H10
的有机物的分子式为C8H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,五种阴离子为
,五种阴离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现将它们分别配成
现将它们分别配成![]() 的溶液,进行如下实验
的溶液,进行如下实验
![]() 测得溶液A、B呈碱性,且碱性为
测得溶液A、B呈碱性,且碱性为![]() ;
;
![]() 向C溶液中滴加稀盐酸,有气体生成;
向C溶液中滴加稀盐酸,有气体生成;
![]() 向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
请根据上述实验现象,回答下列问题
![]() 实验
实验![]() 中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
![]() 分两步写出实验
分两步写出实验![]() 中发生反应的离子方程式______________。
中发生反应的离子方程式______________。
![]() 写出下列四种化合物的化学式:A______________;B______________。
写出下列四种化合物的化学式:A______________;B______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是工业上主要用作有机合成的原料和溶剂,可由最简单芳香烃A经如下流程制得:
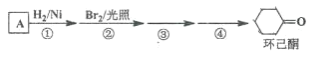
回答下列问题:
(1)反应①的反应类型为_______反应,反应③的反应类型为______。
(2)反应④所用的试剂为_______。
(3)A的同系物(C8H10)所有可能的结构简式为_______。
(4)环己酮的还原产物能与乙酸产生乙酸酯,请写出产生酯的条件。_______
(5)写出A的相邻同系物合成![]() 的合成路线。合成路线常用的表示方式为:______
的合成路线。合成路线常用的表示方式为:______
A![]() B……
B……![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法不正确的是
A. 1,3-二甲苯也称间二甲苯
B. 乙烷和新戊烷分子中所含甲基数之比为1∶2
C. 苯与溴水不能发生加成反应,所以两者混合后无明显现象
D. ![]() 和C4H10的二氯代物的数目不同(不含立体异构)
和C4H10的二氯代物的数目不同(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用下图所示的实验装置来制备纯净、干燥的氯气,并实验其与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
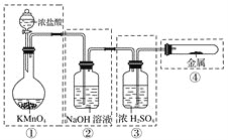
A.①和②处B.只有②处
C.②和③处D.②、③、④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH均为2的盐酸、硫酸、醋酸三瓶溶液
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是________________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是___________________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应过程中放出H2的速率依次为a1、a2、a3,则其关系是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都与氢原子结合。
(1)图中属于烷烃的是______ (填字母)。
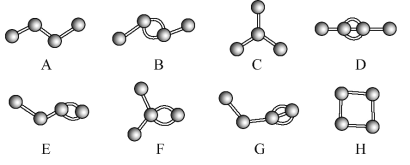
(2) 上图中互为同分异构体的是A与____;B与_____;D与____(填字母)。
Ⅱ、等物质的量的乙烯与甲烷,所含分子数之比_____,碳原子个数之比为_____,若充分燃烧,消耗O2的体积比为______;0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写)__________→________→________→ D→________。
(2)D步骤中液面应调节到______________,尖嘴部分应______________。
(3)滴定终点时锥形瓶中颜色变化是______________。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”、“低”或“不变”)
(5)该烧碱样品纯度的计算式为______________。
Ⅱ. (1)常温下,0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则①混合溶液中由水电离出的c(H+)___(填“>”、“<”或“=”)HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。
c(Cl-)-c(M+)=________ mol/L;c(H+)-c(MOH)=________ mol/L。
(2)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________(填“>7”或“<7”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com