
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
科目:高中化学 来源: 题型:
【题目】某可逆反应aA + bB![]() cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
A.写成2aA + 2bB![]() 2cC,Q值、K值均扩大了一倍
2cC,Q值、K值均扩大了一倍
B.写成2aA + 2bB![]() 2cC,Q值扩大了一倍,K值保持不变
2cC,Q值扩大了一倍,K值保持不变
C.写成cC![]() aA + bB,Q值、K值变为原来的相反数
aA + bB,Q值、K值变为原来的相反数
D.写成cC![]() aA + bB,Q值变为原来的相反数,K值变为倒数
aA + bB,Q值变为原来的相反数,K值变为倒数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置,可以模拟铁的电化学防护。下列说法正确的是( )

A. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于M处
B. 若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
C. 若X为碳棒,K与M连接时,一段时间后溶液的pH减小
D. 若X为锌,K与N连接时,X电极产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据电化学知识回答下列问题。
Ⅰ、某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
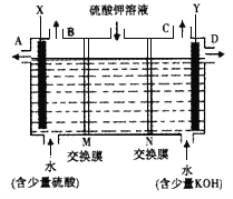
(1)X极与电源的_____(填正或负)极相连,氢气从____ (选填A、 B、C或D)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填阴离子或阳离子,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池正极的电极反应式为___________________
Ⅱ、铅蓄电池是常见的二次电池,其放电反应和充电反应表示如下:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
写出它放电时正极的电极反应式______________________________________;
充电时阴极的电极反应式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________,B接__________。
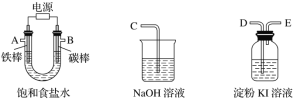
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______________________。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象: __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
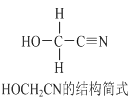
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出七种元素的相关信息,根据以下信息填空:
元素 | 相关信息 |
A | 核外电子数和电子层数相等 |
B | 基态原子2p能级有3个未成对电子 |
C | 在地壳中含量最高 |
D | 目前,在元素周期表中电负性最大 |
E | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
F | 原子序数等于D与E的原子序数之和 |
G | 基态原子2p能级上有两个空轨道 |
(1)写出D在元素周期表中的位置___________________。
(2)14gB的单质分子中π键的个数为____________。
(3)C元素的氢化物的沸点是同族元素氢化物中最高的,原因是________。
(4)B、C、D 3种元素的电负性由大到小的顺序为________(用元素符号表示)。
(5)写出一种与B2互为等电子体的分子或离子____________。
(6)已知BA5为离子化合物,写出其电子式:_______。
(7)第二周期中,第一电离能介于B元素和G 元素间的元素为 ____(填“元素符号”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL 0.40mol/L H2O2 溶液发生催化分解。不同时刻测得生成![]() 的体积(已折算为标准状况)如下表。
的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6min的平均反应速率:v(H2O2)=3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
C. 反应到6min时,c(H2O2)=0.30mol/L
D. 反应到6min时,H2O2 分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验:三组各取30.0 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
产生气体体积/mL | 280 | 336 | 336 |
请回答:
(1)甲组实验中,盐酸______________(选填“适量”“过量”或“不足量”,下同),理由是______________。要算出盐酸的物质的量浓度,题中可作计算依据的数据是______________。求得的盐酸的物质的量浓度为______________。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是______________,求得的Mg、Al的物质的量之比为______________;
(3)在丙组实验之后,向容器中加入1.00 mol·L-1 NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶性固体,求滤液中各溶质的物质的量和所加入NaOH溶液的体积(写计算过程)。___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com