
【题目】在一定温度下,10mL 0.40mol/L H2O2 溶液发生催化分解。不同时刻测得生成![]() 的体积(已折算为标准状况)如下表。
的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6min的平均反应速率:v(H2O2)=3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
C. 反应到6min时,c(H2O2)=0.30mol/L
D. 反应到6min时,H2O2 分解了50%
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 ℃、常压下,将乙醇变为蒸气,然后与乙烯以任意比例混合,混合气体的体积为V L。使该混合气体完全燃烧,需消耗相同条件下的氧气的体积是
A. 2V L B. 2.5V L C. 3V L D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用下图所示的实验装置来制备纯净、干燥的氯气,并实验其与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
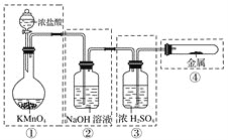
A.①和②处B.只有②处
C.②和③处D.②、③、④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为__。
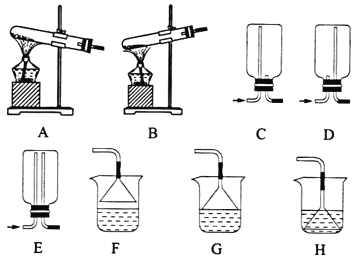
(2)按如图装置进行NH3性质实验。
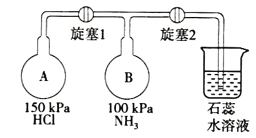
①先打开旋塞1,B瓶中的现象是___,原因是___,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向0.1mol/L醋酸中通入氯化氢气体,下列描述不正确的是( )
A. pH逐渐减小B. c(H+)增大
C. 水的电离程度会不断增大D. Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实可用同一原理解释的是
A.新制的氨水、氯水放置时间较久而变质
B.![]() 能使溴水和品红溶液褪色
能使溴水和品红溶液褪色
C.![]() 和
和![]() 溶液使酸性高锰酸钾溶液的紫色褪去
溶液使酸性高锰酸钾溶液的紫色褪去
D.浓硫酸和浓盐酸长期暴露在空气中浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 原子核外电子排布式为1s2的原子与核外电子排布式为1s22s2的原子化学性质相似
B. Fe3+的最外层电子排布式为3s23p63d5
C. 基态铜原子的最外层的电子排布图: ![]()
D. 基态碳原子的最外层电子排布图:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com