
| A. | 8.7g | B. | 3.15g | C. | 4.35g | D. | 4.0g |
分析 在反应后的溶液中,加入足量的NaOH溶液,生成沉淀为氢氧化镁,根据Mg、Al质量之和以及电子转移守恒列方程计算Mg、Al的物质的量,进而计算氢氧化镁的质量.
解答 解:反应生成2.24L 的NO气体,其物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子物质的量为:0.1mol×3=0.3mol,
设混合物中Mg、Al的物质的量分别为xmol、ymol,根据二者质量与电子转移守恒可得:
$\left\{\begin{array}{l}{24x+27y=3.15g}\\{2x+3y=0.3}\end{array}\right.$
解得:x=0.075、y=0.05,
根据Mg元素守恒,生成氢氧化镁的物质的量为0.075mol,质量为0.075mol×58g/mol=4.35g,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,侧重考查学生分析计算能力,注意利用电子转移守恒解答,明确发生反应的实质为解答关键.


科目:高中化学 来源: 题型:推断题
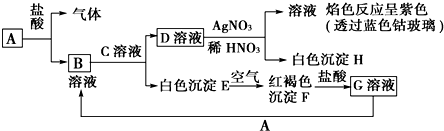
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)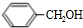 ;C中含有的官能团碳碳双键和醛基(写名称).
;C中含有的官能团碳碳双键和醛基(写名称). .
. .
.


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
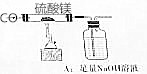 确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:
确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 简单离子半径:T>R |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com