
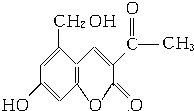
 它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题: .
.分析 (3)含碳碳双键、酚-OH、醇-OH及-COOC-,结合烯烃、酚、醇、酯的性质分析;
(4)丙二醇的分子式是C3H8O2,则2个-OH在不同的C原子上,属于醇类的同分异构体的结构简式CH3CH(OH)CH2OH、CH2(OH)CH2 CH2(OH),
故答案为:CH3CH(OH)CH2OH、CH2(OH)CH2 CH2(OH);
(5)根据元素的含量判断分子式,二甘醇分子中有3个吸收峰,其峰面积之比为2:2:1,说明分子中有3种不同的H,且个数比为2:2;1,1mol二甘醇与足量的金属钠反应生成1molH2,说明含有2个-OH,以此解答该题.
解答 解:(3)A.“亮菌甲素”含苯环和双键,能与H2发生加成反应,故A正确;
B.含双键,能使酸性KMnO4溶液褪色,故B错误;
C.“亮菌甲素”的分子式是C12H10O5,故C正确;
D.“亮菌甲素”分子中含氧官能团为酚-OH、醇-OH及-COOC-,有3种,故D错误;
故答案为:AC;
(4)丙二醇的分子式是C3H8O2,则2个-OH在不同的C原子上,属于醇类的同分异构体的结构简式CH3CH(OH)CH2OH、CH2(OH)CH2 CH2(OH),
故答案为: ;
;
(5)二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,则C、O元素的质量分数都为$\frac{1-9.4%}{2}$=45.3%,则分子中N(C):N(H):N(O)=$\frac{0.453}{12}$:$\frac{0.453}{16}$:$\frac{0.094}{1}$=4:3:10,分子式应为C4H10O3,
二甘醇分子中有3个吸收峰,其峰面积之比为2:2:1,说明分子中有3种不同的H,且个数比为2:2;1,1mol二甘醇与足量的金属钠反应生成1molH2,说明含有2个-OH,则二甘醇结构简式为HOCH2CH2OCH2CH2OH.
故答案为:HOCH2CH2OCH2CH2OH.
点评 本题考查有机物的推断,题目难度中等,易错点为(3),注意分子式的推断为解答该题的关键,结合题目信息分析可能具有的结构.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (Ⅰ)取氯化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (Ⅱ)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O |
| 实验二 | (Ⅰ)取实验一得到的溶液,加入KSCN溶液. (Ⅱ)再加入少量H2O2溶液. | 颜色无明显变化 溶液变红,有少量气泡 |
| 实验三 | (Ⅰ)取10mL 0.1mol/L KI溶液,滴加6滴0.1mol/L FeCl3溶液. (Ⅱ)取少量上述黄色溶液,滴加KSCN溶液. (Ⅲ)另取上述的黄色溶液,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (Ⅰ)向实验三步骤I中所得的黄色溶液中加入2mL CCl4,充分振荡后,分离得到水层;重复操作三次. (Ⅱ)向步骤I中所得水层中加入KSCN溶液. | 颜色无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27克铝与足量的稀硫酸或氢氧化钠溶液充分反应,转移电子物质的量都为3 NA | |
| B. | 一瓶容积为22.4L 的NO2气体所含氮原子个数为NA | |
| C. | 浓度为0.2 mo1•L-1的CaC12溶液中,C1-离子的数目为0.4 NA | |
| D. | 标准状况下,22.4 L H2O含有的水分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下,pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,可用玻璃棒搅拌漏斗中的液体以加快过滤速率 | |
| B. | 用湿润的pH试纸测溶液的pH,因溶液被稀释而使测量值变大 | |
| C. | 酸碱滴定管、容量瓶、分液漏斗使用前必须检查是否漏水 | |
| D. | 酸碱滴定实验中,需用待滴定溶液润洗锥形瓶以减小实验误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4中共价键数目为4NA | |
| B. | 22.4 L O2和N2的混合气体中一定含有的原子数为2NA | |
| C. | 常温常压下,6 g NO2和40 g N2O4混合气体中的原子总数为3NA | |
| D. | 25℃时,1mol•L-1醋酸溶液中所含CH3COOH分子总数一定小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下的某 NaF 溶液中,c(H+)=1×10-10 mol?L-1,说明 NaF 使水的电离减弱 | |
| B. | Mg 在空气中燃烧时发出耀眼的白光,一部分化学能转化为光能 | |
| C. | 纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 | |
| D. | 反应 N2(g)+3H2(g)═2NH3(g)(△H<0)达平衡后,降低温度,正、逆反应速率都减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素.
如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素. ;
; +Br2→
+Br2→ +3HBr;
+3HBr; +NaOH→
+NaOH→ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com