
下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4- + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
科目:高中化学 来源:2015届浙江省“温州八校”高三返校联考化学试卷(解析版) 题型:选择题
关于可逆反应:aA(g)+bB(g)  cC(g)+dD(g) ΔH的有关图像如下:
cC(g)+dD(g) ΔH的有关图像如下:
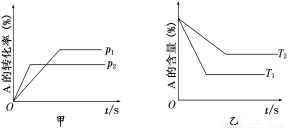
则下列不正确的是
A.p1<p2 T1>T2
B.减小压强,正逆反应速率都减小,平衡右移
C.ΔH>0 ΔS>0
D.升高温度,混合气体的平均摩尔质量增大
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三上学期第一次测试化学试卷(解析版) 题型:填空题
(15分)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,已知此反应是放热反应。 NH3+CO2+H2O+NaCl(饱和)= NaHCO3(晶体)↓+NH4Cl
(1)利用上述反应原理,设计如下图所示装置,制取碳酸氢钠晶体.B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.制取碳酸氢钠晶体可供选用的药品有:A.石灰石 B.生石灰 C.6mol/L盐酸 D.稀硫酸 E.浓氨水 F.饱和氯化钠溶液。
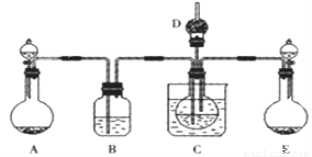
①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④E装置向C中通气的导管不能插入液面下的原因是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行如图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作Ⅲ的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
A.X、Y元素的金属性 X<Y
B.一定条件下, Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:选择题
在一定的温度、压强下,向100mLCH4和Ar的混合气体中通入400mLO2,点燃使其完全反应,最后在相同条件下得到干燥气体460mL,则反应前混合气体中CH4和Ar的物质的量之比为 ( )
A.1:4 B. 1:3 C. 1:2 D. 1:1
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸 D.若甲为NaOH 溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为
A.0.5 mol /L B.1.0 mol/L C.2.0 mol/LD.3.0 mol/L
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用,下列说法不正确的是
A.氧化镁用作耐火材料
B.Na2O常用于潜水艇或呼吸面具的供氧剂
C.明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
D.FeCl3溶液可用于刻制印刷铜电路板
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:实验题
(15分)固体硝酸盐加热易分解且产物较复杂。以Mg(NO3)2为研究对象,四个学习小组拟通过实验探究其热分解的产物,分别提出如下4种猜想:
甲组:Mg(NO2)2、NO2、O2 乙组:MgO、NO2、O2
丙组:MgO、NO2、N2 丁组:Mg3N2、O2
(1)实验前,小组成员经讨论认定 组的猜想一定不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对其他小组猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略)进行探究:

A B C D
(2)实验过程
①简述检验该装置气密性的方法 。
②称取硬质试管A的质量为18.0g,试管A与Mg(NO3)2固体共21.8 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 然后固定在管中固体部位下加热。
③观察到A中有红棕色气体生成,C中有气泡。
④待样品完全分解,A装置冷却至室温、称量,测得硬质试管A和剩余固体的总质量为19.0g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①证明一定有O2生成的依据是 ,与此相关的化学原理为(用化学方程式表示) 。
根据实验现象和剩余固体的质量经分析可初步确认猜想_______组结论是正确的。
②一位同学认为上述装置不能确认分解产物中有O2,他的理由你认为可能是 , 如果需改进装置,应该 。
(4)据以上分析,Mg(NO3)2分解的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com