
����Ŀ��ʵ���ҿ������̿���Ҫ�ɷ�ΪMnO2���Ʊ�KMnO4���������£����̿����������KOH��KClO3�ڸ����·�Ӧ����������أ�K2MnO4����KCl����ˮ�ܽ⣬��ȥ��������Һ�ữ��K2MnO4ת��ΪMnO2��KMnO4����ȥMnO2������Ũ����Һ���ᾧ�õ�����ɫ����״KMnO4����ش�
��1�����̿��Ʊ�K2MnO4�Ļ�ѧ����ʽ��_______________________��
��2��K2MnO4�Ʊ�KMnO4�����ӷ���ʽ��_______________��
��3������2.5g���̿�MnO2 80������������ʵ�飬KMnO4�����۲���Ϊ_______________��
��4��KMnO4�����ȵľ������ữ��Na2C2O4��Һ��Ӧ����Mn2+��CO2���÷�Ӧ�Ļ�ѧ����ʽ��________________________��
��5�������Ƶ�KMnO4��Ʒ0.165g��ǡ����0.335g Na2C2O4��Ӧ��ȫ����KMnO4�Ĵ���Ϊ___��
���𰸡�(12��)(1��3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O(2��)
3K2MnO4+KCl+3H2O(2��)
��2��3Mn![]() +4H+ = MnO2��+2Mn
+4H+ = MnO2��+2Mn![]() +2H2O(2��)
+2H2O(2��)
��3��������������ѧ����ʽ��֪����Ӧ����������ļ�����ϵΪ��(3��)
![]()
![]() MnO2K2MnO4
MnO2K2MnO4![]() KMnO4
KMnO4
87 158��![]()
2.5��80% x
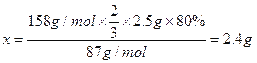
��KMnO4�����۲�����2.4g
��4��2KMnO4+5Na2C2O4+8H2SO4![]() K2SO4+2MnSO4+5Na2SO4+10CO2��+8H2O(2��)
K2SO4+2MnSO4+5Na2SO4+10CO2��+8H2O(2��)
��5�����KMnO4�Ĵ���Ϊy�����ݻ�ѧ����ʽ��֪(3��)
![]() KMnO4������Na2C2O4
KMnO4������Na2C2O4
![]() ��158 134
��158 134
0.165 �� y 0.335
����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A������ơ��ƿ��ƿ�����Ϸ��������ĭ
B�������ڳ�ʪ�Ŀ�������������
C��ʵ�����г����ű���ʳ��ˮ�ķ����ռ�����
D����ҵ����������Ĺ�����ʹ�ù����Ŀ�������߶��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.2 moI��L-l��Na2CO3��Һ��0.2 moI��L-l������������Ϻ�������Һ�в����������Ũ�ȵĹ�ϵ��ͼ��ʾ��X��Y��Z����ʾ��̼��������˵����ȷ����

A. A����Na+Ũ��
B. ����Һ��c(OH-)>c(Y)
C. �����Һ�м�ˮϡ�ͣ���������Ũ�Ⱦ���С
D. �û����Һ�У�c(X)+c(Y)+c(Z)=2c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�2molA��1molB����2L�ܱ������з�����Ӧ��2A(g)+B(g) ![]() 2C(g)���ֱ���Tl��T2ʱ���������C�����ʵ�����ʱ��仯��ͼ��ʾ������˵����ȷ����
2C(g)���ֱ���Tl��T2ʱ���������C�����ʵ�����ʱ��仯��ͼ��ʾ������˵����ȷ����
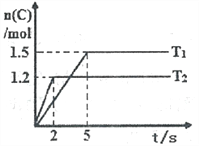
A. T1<T2
B. �÷�Ӧ���¶�ΪT1ʱ�ﵽƽ��ʱ��������A��C�����ʵ���Ũ�����
C. �¶�ΪT2ʱ��2s��B��ƽ������Ϊ0.3mol��L-1��s-l
D. �¶�ΪT1ʱ����ƽ��ʱ��Ӧ��A��ת����Ϊ60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д�����ǣ� ��
A. COȼ���Ƿ��ȷ�Ӧ B. H2SO4��NaOH��Ӧ�Ƿ��ȷ�Ӧ
C. CaO��H2O��Ӧ�����ȷ�Ӧ D. CaCO3���ȷֽ������ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A�����Ȼ��������ܽ���Ũ�����������Ȼ�����Һ
B���¶����ߣ�ˮ�ĵ���̶�����
C����ˮ�м���̼��ƣ�Ư������ǿ
D����ӦH2(g)+I2(g)![]() 2HI(g)��ƽ�����С��Ӧ������������������ɫ����
2HI(g)��ƽ�����С��Ӧ������������������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������MgCl2��AlCl3��CuCl2��FeCl3��FeCl2��NH4Cl������Һ�����ֻ��һ���Լ����������ֿ����������Լ��ǣ� ��
A.��ˮ
B.AgNO3
C.NaOH
D.BaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ھ����ܱ������з�����Ӧ��aM(g)+bN(g) ![]() cW(g) ��ƽ����M�����Ũ��Ϊ0.5mol/L�������ܱ��������������1�����ٴ�ƽ��ʱ�����M�����Ũ��Ϊ0.3mol/L��������������ȷ����
cW(g) ��ƽ����M�����Ũ��Ϊ0.5mol/L�������ܱ��������������1�����ٴ�ƽ��ʱ�����M�����Ũ��Ϊ0.3mol/L��������������ȷ����
A����Ӧ�������� B��ƽ�������ƶ�
C����ϵ�¶����� D��W��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����շۣ�Na2S2O4���м�ǿ�Ļ�ԭ�ԣ�����ˮ��ʪ������ֽⷢ�ȣ����ڼ��Ի����½��ȶ����ش��������⣺
(1)����������Ʊ�

����������ķ���װ�ÿ���ѡ����ͼ�е�_____________�����д��ĸ������Ӧ�Ļ�ѧ����ʽΪ______________________��
�����ռ�һƿ����Ķ�������ѡ����ͼ�е�װ�ã���ӿڵ�����˳��Ϊ����װ����__________________����______��______�� ____________����������������Сд��ĸ��ʾ��
(2)���շ۵��Ʊ�
��35-45���£���SO2����ͨ��п��һˮ����Һ�У���ͼ����ʹ֮������Ӧ����ZnS2O4������Ӧ��ȫ�����ߺ���ˮԡװ�ò���ȴ�����£���������ƿ�м���18%��NaOH��Һ��ʹ֮������Ӧ����Na2S2O4��Zn(OH)2����һϵ�в�����õ���ˮNa2S2O4��Ʒ��

��ʵ�鿪ʼʱ��Ӧ�ȹر�ֹˮ��K3����K1��K2��ͨ��һ��ʱ��SO2����ԭ����__________��
��ͨ���۲�_________________������ֹˮ��K1������SO2�����١�
����ZnS2O4����Na2S2O4�Ļ�ѧ����ʽΪ_____________��
(3)��ȡ2.0gNa2S2O4��Ʒ������ˮ�У����100mL����Һ��ȡ��10mL����Һ���Թ��У���0 .10 mol/L��KMnO4��Һ�ζ����ζ����յ�ʱ����ΪNa2SO4��MnSO4�����ظ���������2�Σ�ƽ��������Һ12.00mL�������Ʒ��Na2S2O4����������Ϊ_______�����ʲ����뷴Ӧ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com