
【题目】某化学兴趣小组用下图装置制取并探究氯气的性质。
A装置中发生反应的化学方程式: KMnO4+ HCl(浓) == KCl+ MnCl2 + Cl2↑+ H2O,____________
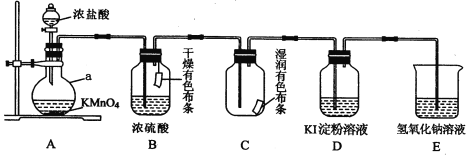
(1)制取氯气反应中MnCl2是__________ 产物(填“氧化”或“还原”)。
(2)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,其褪色原因是______________________________________。
(3)当氯气进入D装置后,可观察到溶液颜色变为_____________,写出相关反应的化学方程式___________________________________。
(4)写出E装置中反应的离子方程式___________________________。
(5)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_________L氯气。被氧化的HCl的物质的量是___________。
(6)若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液②NaHCO3溶液③KBr溶液④NaCl溶液,正确选择是______(填序号)。
【答案】2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 还原 C 氯气与水反应生成漂白性物质(HClO) 蓝色 Cl2+2KI=I2+2KCl Cl2+2OH-=Cl-+ClO-+H2O 11.2 1mol ②
【解析】
根据反应中Mn和Cl元素的化合价变化情况结合守恒法配平反应的方程式。
(1)根据化学反应前后Mn元素价态分析判断;
(2)依据Cl2本身不具有漂白性,但是Cl2与H2O反应生成的HClO具有漂白性来分析;
(3)氯气具有强氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;
(4)氯气有毒不能直接排放到空气中;
(5)根据n=m÷M结合反应的方程式计算;
(6)用湿毛巾捂住鼻子防止中毒,应选弱碱性物质吸收氯气。
反应中Mn元素化合价从+7价降低到+2价,得到5个电子,氯元素化合价从-1价升高到0价,失去1个电子,则根据电子得失守恒以及原子守恒可知反应的方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(1)由方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O得反应前后Mn元素价态降低,因此KMnO4是氧化剂,所以MnCl2是还原产物;
(2)因为干燥的Cl2本身不具有漂白性,不能将有色物质褪色,故B中干燥布条不变色,C中湿润的布条有水,氯气与水反应生成的HClO具有漂白性能将有色物质褪色,故C中褪色;
(3)氯气具有强氧化性,能够氧化碘离子生成单质碘,化学方程式为Cl2+2KI=I2+2KCl,碘遇到淀粉变蓝,所以会看到溶液变蓝;
(4)氯气是有毒气体,不能直接排放到空气中,因此用碱液吸收,所以E装置中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(5)n(KMnO4)=31.6g÷158g/mol=0.2mol,根据方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O可知生成氯气是0.5mol,在标况下的体积是0.5mol×22.4L/mol=11.2L;根据氯原子守恒可知被氧化的氯化氢是0.5mol×2=1mol;
(6)用湿毛巾捂住鼻子防止中毒,应选弱碱性物质吸收氯气,只有②符合,而①碱性太强,③反应生成有毒物质溴,④抑制氯气溶解,故答案为②。


科目:高中化学 来源: 题型:
【题目】(1)已知由金属钠制得氧化钠,可用多种方法:a.4Na+O2===2Na2O,b.4Na+CO2===2Na2O+C,c.2NaNO2+6Na===4Na2O+N2↑。
①在上述三种方法中,最好的方法是________(填序号),原因是________________。
②上述反应c中NaNO2作________剂,当有1 mol NaNO2反应时,电子转移的数目是________________________________________________________________________。
(2)现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(注:Na2O2可以与H2O、CO2反应):
①装置Ⅳ中盛放的药品是________,其作用是____________________________。


②若规定气体的气流方向从左到右,则组合实验装置时各仪器接口的标号字母(a、b……)顺序:空气进入________,________接________,________接________,________接________。
③装置Ⅱ的作用____________________________________________________。
④操作中通空气和加热的顺序为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物用途错误的是( )
A.Al2O3用来制造耐高温的实验仪器
B.Fe2O3常用作油漆和涂料
C.过氧化钠可以用作供氧剂、漂白剂等
D.熟石灰常直接用来治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染。
(1)请写出NH3的电子式________________。
(2)已知:①H2O(l)=H2O(g) △H1=+44.0kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+229.3 kJ·mol-1
③4NH3(g)+5O2(g)= 4NO(g)+6H2O(g)△H3=-906.5kJ·mol-1
则反应④4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)的△H=_______;该反应的平衡常数K的表达式为__________;增加压强,该反应中NO的转化率将____________ (填“提高”、“不变”或“降低”)。
(3)一定温度下,在容积固定的密闭容器中,发生反应④,下列能判断该反应达到平衡的是____________ (填标号)
A.c(NH3)=c(N2) B.容器中压强不变
C.容器中混合气体的密度不变 D.1molN-H键断裂的同时,生成1molO-H键
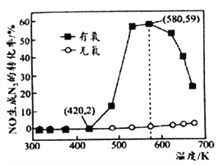
(4)某小组研究了NH3和NO在Ag2O催化剂表面发生上述反应④,其中NO在一定时间内的转化率随温度变化的结果如右图所示。在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是____________。在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是____________。
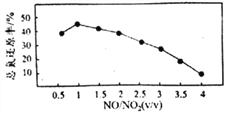
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氨还原率与配比关系如右图。
(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,将N元素转变为对环境无害的气体写出该反应的化学方程式____________。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,适宜用的试剂是( )
A. NaOH溶液 B. Ba(OH)2溶液 C. 盐酸 D. 氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳骨架如下的烃。下列说法正确的是( )
![]()
①a和d是同分异构体 ②b和c是同系物 ③a和d都能发生加聚反应 ④只有b和c能发生取代反应
A. ①② B. ①④
C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验验证海带中含有碘,其第一步操作是将足量海带灼烧成灰烬。该过程中将使用到:①试管、②瓷坩埚、③坩埚钳、④泥三角、⑤酒精灯、⑥烧杯、⑦量筒中的实验仪器有( )
A.⑤⑥B.①⑤C.②③⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到目的的是
A.用NaOH溶液除去镁粉中的铝粉
B.将Na2O2投入到FeCl2溶液中制备氢氧化铁
C.用盐酸和AgNO3溶液鉴定Cl-
D.用加热的方法鉴别Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用10mol/L的浓盐酸配制230mL1mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸___________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等。
(3)若实验遇下列情况,溶液的物质的量浓度是: ①偏高 ②偏低 ③不变
A、加水定容时越过刻度线_________(填序号)。
B、忘记将洗涤液转入容量瓶__________(填序号)。
C、容量瓶内壁附有水珠而未干燥处理__________ (填序号)。
D、量取的浓盐酸置于烧杯中较长时间后配制__________ (填序号)。
(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,若锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com