
【题目】实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,适宜用的试剂是( )
A. NaOH溶液 B. Ba(OH)2溶液 C. 盐酸 D. 氨水
科目:高中化学 来源: 题型:
【题目】下图为我国目前的能源消费结构图:
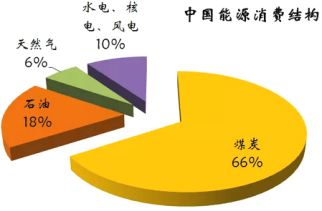
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤碳为主,但直接燃烧煤炭的弊端是_____________________________________________。
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:
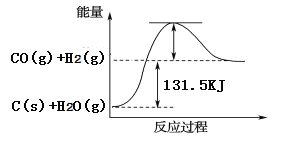
根据以上数据,写出该反应的热化学方程式_____________________________;
(3)直接燃烧水煤气的能量利用率远远低于燃料电池,请写出碱性水煤气燃料电池的负极反应式________________________,______________________。
(4)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用H2、CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度 | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.00 | 2.5 |
③3H2(g)+CO2(g) | K3 | ||
在体积一定的密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______。
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
(5)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g) 的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v正_______ v逆(填“> ”、“= ”或“< ")。
(6)在3L容积可变的密闭容器中发生反应②,已知c(CO)随反应时间t变化曲线I如图所示,若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。

当曲线I变为曲线II时,改变的条件可能是________。当曲线I变为曲线III时,改变的条件可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿的主要成分为PbS,含铅可达86.6%。以方铅矿为原料制备铅蓄电池的电极材料PbO2的工艺流程如图所示:
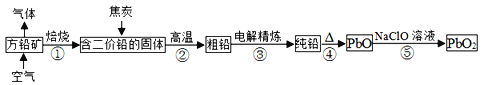
(1)方铅矿焙烧后排出气体的主要成分是______(填化学式),可用于工业制备________。
(2)步骤②中焦炭的作用是________。
(3)“粗铅”的杂质主要有锌、铁、铜、银等。电解精炼时,________作阴极,阴极反应式为________,阳极泥的主要成分是________。
(4)步骤⑤中制备PbO2的离子方程式________。
(5)已知:常温下,Ksp(PbS)=8×10-28、Ka1(H2S)=1.3×10-7、Ka2(H2S)=7.1×10-15。常温下,向Pb(NO3)2溶液中通入H2S气体,发生反应的离子方程式是________;结合数据分析,该反应能否进行得基本完全?________(写出计算推理过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图装置制取并探究氯气的性质。
A装置中发生反应的化学方程式: KMnO4+ HCl(浓) == KCl+ MnCl2 + Cl2↑+ H2O,____________
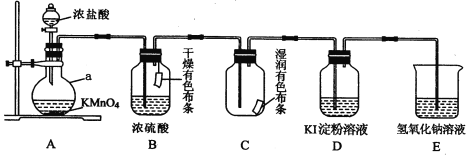
(1)制取氯气反应中MnCl2是__________ 产物(填“氧化”或“还原”)。
(2)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,其褪色原因是______________________________________。
(3)当氯气进入D装置后,可观察到溶液颜色变为_____________,写出相关反应的化学方程式___________________________________。
(4)写出E装置中反应的离子方程式___________________________。
(5)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_________L氯气。被氧化的HCl的物质的量是___________。
(6)若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液②NaHCO3溶液③KBr溶液④NaCl溶液,正确选择是______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a LNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是 ( )
A. ω=![]()
B. c=![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com