
【题目】下列实验不能达到目的的是
A.用NaOH溶液除去镁粉中的铝粉
B.将Na2O2投入到FeCl2溶液中制备氢氧化铁
C.用盐酸和AgNO3溶液鉴定Cl-
D.用加热的方法鉴别Na2CO3和NaHCO3
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2 )中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
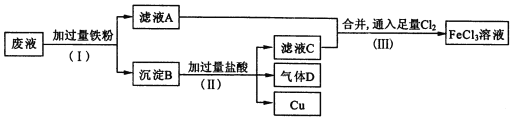
(1)步骤(Ⅰ)中分离操作名称 是____________。
(2)沉淀B中主要含有_________,气体D是______________;
(3)写出步骤(Ⅲ)中生成FeCl3的化学方程式____________________;
(4)步骤(Ⅲ)中,将氯气换成H2O2也能达到同样的目的,写出H2O2将Fe2+氧化为Fe3+的离子方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图装置制取并探究氯气的性质。
A装置中发生反应的化学方程式: KMnO4+ HCl(浓) == KCl+ MnCl2 + Cl2↑+ H2O,____________
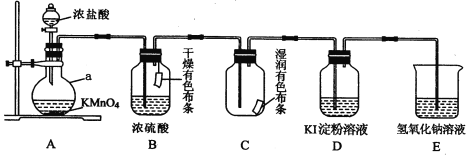
(1)制取氯气反应中MnCl2是__________ 产物(填“氧化”或“还原”)。
(2)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,其褪色原因是______________________________________。
(3)当氯气进入D装置后,可观察到溶液颜色变为_____________,写出相关反应的化学方程式___________________________________。
(4)写出E装置中反应的离子方程式___________________________。
(5)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_________L氯气。被氧化的HCl的物质的量是___________。
(6)若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液②NaHCO3溶液③KBr溶液④NaCl溶液,正确选择是______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
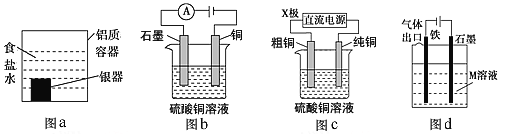
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据2Fe2++Cl2=2Fe3++Cl-;2Fe3++Cu=2Fe2++Cu2+;Fe+Cu2+=Fe2++Cu上述反应判断氧化剂的氧化性强弱顺序正确的是
A.Cl2>Fe3+>Cu2+B.Fe3+>Cl2>Cu2+
C.Cu2+>Fe3+>Cl2D.Cl2>Cu2+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点、大立方体的体心和8个小立方体的体心,那么大立方体的面心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
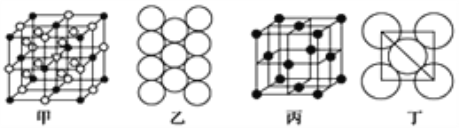
若已知Al的原子半径为r pm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________ g/cm3 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe 及少量Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
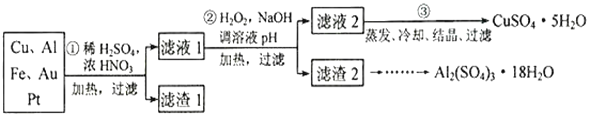
请回答下列向题:
(1)第①步Cu与酸反应的离子方程式___________________,得到滤渣1的主要成分为_________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的Fe2+离子氧化为Fe3+,写出该反应的离子方程式_______________________________,用H2O2做氧化的优点是__________________。
(3)滤渣2的主要成分中Al(OH)3和Fe(OH)3在生产中如何分离两种沉淀,写出反应的离子方程式:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com