
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
【答案】B
【解析】A、反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,H2O2中氧元素化合价升高,生成氧气,根据H元素守恒可知还生成水,A错误;B、由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(Cl2)=n(FeBr2),即n(Cl2):n(FeBr2)=1:2,B正确;C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍,生成1mo1Cl2,转移电子为2mo1,C错误;D、氧化剂的氧化性强于氧化产物的氧化性,由③可知氧化性MnO4->Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物用途错误的是( )
A.Al2O3用来制造耐高温的实验仪器
B.Fe2O3常用作油漆和涂料
C.过氧化钠可以用作供氧剂、漂白剂等
D.熟石灰常直接用来治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验验证海带中含有碘,其第一步操作是将足量海带灼烧成灰烬。该过程中将使用到:①试管、②瓷坩埚、③坩埚钳、④泥三角、⑤酒精灯、⑥烧杯、⑦量筒中的实验仪器有( )
A.⑤⑥B.①⑤C.②③⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到目的的是
A.用NaOH溶液除去镁粉中的铝粉
B.将Na2O2投入到FeCl2溶液中制备氢氧化铁
C.用盐酸和AgNO3溶液鉴定Cl-
D.用加热的方法鉴别Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是一种重要的化工原料,某研究性学习小组查阅资料后利用图1所示装置制备无水氯化铝(反应温度为450℃-500℃)。资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃ 升华,在空气中能吸收水分,发生水解。
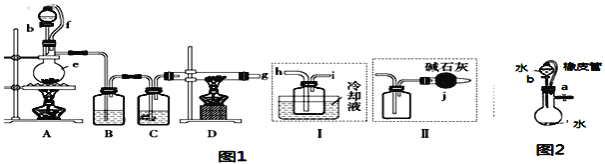
回答下列问题:
(1)某同学检验装置A部分的气密性,如图2所示,关闭图装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:A部分装置是否漏气?____________ (填“漏气”、“不漏气”或“无法确定”),判断理由:________________________。
(2)装置e的名称是_______________________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置I;方案乙:g接装置II。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
方案 | 不足之处 |
甲 | ______ |
乙 | ______ |
(4)在上述(3)的评价基础上,请设计一个合理方案:______________________。
(5)A部分装置中发生反应生成氯气的离子方程式为___________________________,若生成标准状况下的氯气22.4L,需要10mol·L-1的浓盐酸的体积______400mL(填大于、小于或等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验
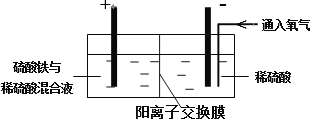
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相)![]() R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是 。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁粉是焰火、闪光粉中不可缺少的原料,工业制造镁粉是将镁蒸气在气体中冷却,下列可作为冷却剂的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2 ⑥H2O
A. ①②⑤⑥B. ③④⑥C. ③⑥D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用10mol/L的浓盐酸配制230mL1mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸___________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等。
(3)若实验遇下列情况,溶液的物质的量浓度是: ①偏高 ②偏低 ③不变
A、加水定容时越过刻度线_________(填序号)。
B、忘记将洗涤液转入容量瓶__________(填序号)。
C、容量瓶内壁附有水珠而未干燥处理__________ (填序号)。
D、量取的浓盐酸置于烧杯中较长时间后配制__________ (填序号)。
(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,若锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+B=C+D的能量变化如图所示(E1、E2均为正值),下列说法正确的是
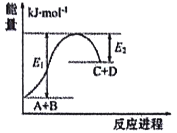
A. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
B. 该反应只有在加热条件下才能进行
C. A和B的总能量一定高于C和D的总能量
D. 该反应吸收的能量为(E1-E2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com