
【题目】无水氯化铝是一种重要的化工原料,某研究性学习小组查阅资料后利用图1所示装置制备无水氯化铝(反应温度为450℃-500℃)。资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃ 升华,在空气中能吸收水分,发生水解。
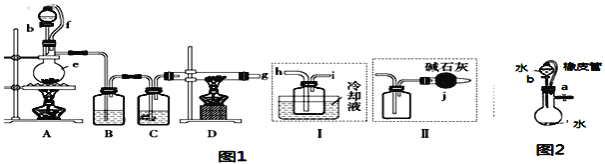
回答下列问题:
(1)某同学检验装置A部分的气密性,如图2所示,关闭图装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:A部分装置是否漏气?____________ (填“漏气”、“不漏气”或“无法确定”),判断理由:________________________。
(2)装置e的名称是_______________________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置I;方案乙:g接装置II。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
方案 | 不足之处 |
甲 | ______ |
乙 | ______ |
(4)在上述(3)的评价基础上,请设计一个合理方案:______________________。
(5)A部分装置中发生反应生成氯气的离子方程式为___________________________,若生成标准状况下的氯气22.4L,需要10mol·L-1的浓盐酸的体积______400mL(填大于、小于或等于)。
【答案】无法确定 由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶蒸馏烧瓶甲①空气中的水蒸气进入产品收集装置,使产品水解②没有尾气的处理,氯气会污染环境。乙①收集产品的导气管太细,易堵塞②没有冷凝装置,产品易损失在装置I 的i处连接盛有碱石灰的干燥管j2Cl-+4H++MnO2 ![]() Cl2+Mn2++2H2O大于
Cl2+Mn2++2H2O大于
【解析】
(1) 橡皮管将装置中两个容器内的气体连通,不管是否漏气,水在重力的作用下总能往烧瓶中流入,因此无法确定装置是否漏气,故答案为:无法确定;由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶;
(2)根据图示,装置e是蒸馏烧瓶;
(3)氯化铝在178℃ 升华,在空气中能吸收水分,发生水解,如果收集产品的导管太细,易堵塞导管;制取的四氯化硅需要冷却;由于尾气中含有氯气,要设置尾气处理装置,氯化铝易水解,要避免空气中的水蒸气进入产品收集装置,故答案为:甲:①空气中的水蒸气进入产品收集装置,使产品水解;②没有尾气的处理,氯气会污染环境;乙: ①收集产品的导气管太细,易堵塞;②没有冷凝装置,产品易损失;
(4)根据上述分析,合理方案为在装置I 的i处连接盛有碱石灰的干燥管j,故答案为:在装置I 的i处连接盛有碱石灰的干燥管j;
(5)A部分装置中二氧化锰与浓盐酸反应生成氯气,反应的离子方程式为2Cl-+4H++MnO2 ![]() Cl2+Mn2++2H2O,若生成标准状况下的氯气22.4L,氯气的物质的量为1mol,随着反应的进行,盐酸浓度减小,变成稀盐酸后,反应将不能进行,需要HCl超过4mol,即需要需要10mol/L的浓盐酸的体积超过
Cl2+Mn2++2H2O,若生成标准状况下的氯气22.4L,氯气的物质的量为1mol,随着反应的进行,盐酸浓度减小,变成稀盐酸后,反应将不能进行,需要HCl超过4mol,即需要需要10mol/L的浓盐酸的体积超过![]() =0.4L=400mL,故答案为:大于。
=0.4L=400mL,故答案为:大于。


科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的工业原料,可以制备如下图所示的一系列物质(部分产物未标出)
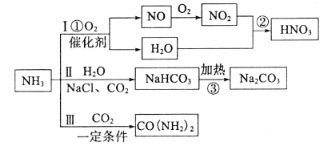
(1)线路Ⅰ为硝酸的制备
写出反应①的化学方程式________;反应②中氧化剂与还原剂的物质的量之比为_______,工业尾气中的氮氧化物常采用碱液法吸收,若NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是_______。
(2)路线为Ⅱ纯碱的制备
写出反应③的化学方程式________,最终得到的纯碱中可能含有NaCl,检验是否存在NaCl的实验方案是________
(3)路线Ⅲ为尿素的制备
写出合成尿素的化学方程式________
(4)实验室中需要少量氨气,写出制备氨气的化学方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为: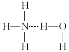
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a LNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是 ( )
A. ω=![]()
B. c=![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸丙二酯(PTT)是一种性能优异的新型聚酯纤维材料和热塑性聚酯材料,是当前国际上最新开发的热门高分子新材料。PTT的一种合成路线如图所示。
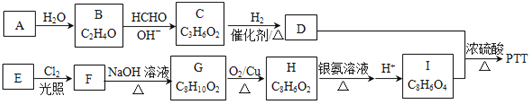
已知: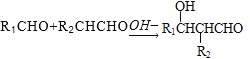
试回答下列问题:
(1)已知A→B是加成反应,A的分子式为________,C中含有的官能团是_________(填名称)。
(2)有机物D的名称为_______________________。(用系统命名法命名)
(3)芳香烃E的一氯代物只有2种,则E的结构简式______________。
(4)由D与I合成PTT的化学方程式为______________,该反应的反应类型为____________。
(5)有机物G的同分异构体有很多种,同时符合下列条件的同分异构体有________种。
①能与FeCl3溶液发生显色反应 ②苯环上只有三个取代基 ③分子中含有两个—OH。
其中核磁共振氢谱显示有5组峰,且峰面积之比为3∶2∶ 2∶ 2∶ 1的是__________(填结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com