
【题目】氨气是一种重要的工业原料,可以制备如下图所示的一系列物质(部分产物未标出)
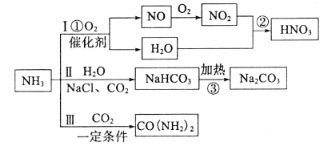
(1)线路Ⅰ为硝酸的制备
写出反应①的化学方程式________;反应②中氧化剂与还原剂的物质的量之比为_______,工业尾气中的氮氧化物常采用碱液法吸收,若NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是_______。
(2)路线为Ⅱ纯碱的制备
写出反应③的化学方程式________,最终得到的纯碱中可能含有NaCl,检验是否存在NaCl的实验方案是________
(3)路线Ⅲ为尿素的制备
写出合成尿素的化学方程式________
(4)实验室中需要少量氨气,写出制备氨气的化学方程式________
【答案】4NH3+5O2![]() 4NO+6H2O 1:2 NaNO2 2NaHCO3
4NO+6H2O 1:2 NaNO2 2NaHCO3 ![]() Na2CO3十H2O+CO2↑ 取少量样品于试管中并加水溶解,加入足量稀硝酸,再加入硝酸银溶液,若岀现白色沉淀,则证明纯碱中含有NaCl 2NH3+CO2
Na2CO3十H2O+CO2↑ 取少量样品于试管中并加水溶解,加入足量稀硝酸,再加入硝酸银溶液,若岀现白色沉淀,则证明纯碱中含有NaCl 2NH3+CO2![]() CO(NH2)2+H2O 2NH4Cl+Ca(OH)2
CO(NH2)2+H2O 2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
根据图中物质书写方程式,掌握氧化还原反应的中氧化剂和还原剂的分析,根据碳酸氢钠的受热分解书写方程式,根据实验室用氯化铵和氢氧化钙制取氨气写方程式。
(1)氨气和氧气反应生成一氧化氮和水,方程式为4NH3+5O2![]() 4NO+6H2O ;反应②为二氧化氮和水反应生成硝酸和一氧化氮,其中二氧化氮做氧化剂和还原剂,比例为 1:2;NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,根据元素化合价变化分析,生成物中氮元素的化合价只能为+3价,则该钠盐的化学式是NaNO2;
4NO+6H2O ;反应②为二氧化氮和水反应生成硝酸和一氧化氮,其中二氧化氮做氧化剂和还原剂,比例为 1:2;NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,根据元素化合价变化分析,生成物中氮元素的化合价只能为+3价,则该钠盐的化学式是NaNO2;
(2)碳酸氢钠受热分解生成碳酸钠和水和二氧化碳,方程式为2NaHCO3 ![]() Na2CO3 +H2O+CO2↑,检验碳酸钠中是否含有氯化钠,应先排除碳酸根离子的干扰,即加入足量的硝酸将溶液酸化,再检验氯离子,方法为取少量样品于试管中并加水溶解,加入足量稀硝酸将溶液酸化,再加入少量的硝酸银溶液,若岀现白色沉淀,则证明纯碱中含有NaCl;
Na2CO3 +H2O+CO2↑,检验碳酸钠中是否含有氯化钠,应先排除碳酸根离子的干扰,即加入足量的硝酸将溶液酸化,再检验氯离子,方法为取少量样品于试管中并加水溶解,加入足量稀硝酸将溶液酸化,再加入少量的硝酸银溶液,若岀现白色沉淀,则证明纯碱中含有NaCl;
(3)氨气和二氧化碳反应生成尿素和水,方程式为:2NH3+CO2![]() CO(NH2)2+H2O;
CO(NH2)2+H2O;
(4)实验室用氯化铵和氢氧化钙反应生成氨气,方程式为: 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理方法正确的是
A. 金属钠着火,立即用水扑灭
B. 实验结束后,用嘴吹灭酒精灯
C. 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗
D. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA
B. 1L0.1mol·L-1的醋酸溶液中含有氢离子数目为0.1NA
C. 标准状况下,2.24LCCl4含碳原子数目为0.1NA
D. 将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几种物质:
①CO2 ②Cu ③FeCl3溶液 ④H2SO4 ⑤氢氧化铁胶体 ⑥Al2(SO4)3固体 ⑦乙醇 ⑧氨水 ⑨BaSO4固体 ⑩盐酸
(1)上述物质中属于电解质的是__________,属于非电解质的是__________。(填写编号)
(2)下列关于③和⑤的说法正确的是____________(填字母序号)。
a.都不稳定,密封静置会产生沉淀 b.⑤能产生丁达尔效应,而③不能
c.分散质微粒都可以通过滤纸 d.加入盐酸都会先产生沉淀,后溶解
(3)②与④的浓溶液反应的化学反应方程式为________________________________。
(4)写出制备⑤的离子反应方程式 ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 含大量Fe3+的溶液中:Na+、Mg2+、SO42—、SCN—
B. ![]() =106的溶液中:NH4+、K+、AlO2—、NO3—
=106的溶液中:NH4+、K+、AlO2—、NO3—
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42—、Cl—
D. 1.0 mol·L—1的KNO3溶液中:Fe2+、H+、Cl—、I—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是一种重要的化工原料,某研究性学习小组查阅资料后利用图1所示装置制备无水氯化铝(反应温度为450℃-500℃)。资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃ 升华,在空气中能吸收水分,发生水解。
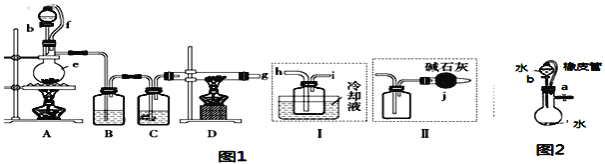
回答下列问题:
(1)某同学检验装置A部分的气密性,如图2所示,关闭图装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:A部分装置是否漏气?____________ (填“漏气”、“不漏气”或“无法确定”),判断理由:________________________。
(2)装置e的名称是_______________________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置I;方案乙:g接装置II。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
方案 | 不足之处 |
甲 | ______ |
乙 | ______ |
(4)在上述(3)的评价基础上,请设计一个合理方案:______________________。
(5)A部分装置中发生反应生成氯气的离子方程式为___________________________,若生成标准状况下的氯气22.4L,需要10mol·L-1的浓盐酸的体积______400mL(填大于、小于或等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①RNO2![]() RNH2;
RNH2;
②![]() +HOSO3H
+HOSO3H![]() +H2O;
+H2O;
③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。 以下是用苯作原料制备某些化合物的转化关系图:

(1)A是一种密度比水______ (填“小”或“大”)的无色液体;A转化为B的化学方程 式是______。
(2)在“![]() ”的所有反应中属于取代反应的是_________(填字母),属于加成反应的是________(填字母);用1H核磁共振谱可以证明化合 物D中有__________种处于不同化学环境的氢。
”的所有反应中属于取代反应的是_________(填字母),属于加成反应的是________(填字母);用1H核磁共振谱可以证明化合 物D中有__________种处于不同化学环境的氢。
(3) B 中 苯 环 上 的 二 氯 代 物 有 _____种 同 分 异 构 体 ; CH3NH2 的 所 有 原 子_____(填“可能”或“不可能”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处 SO42-从右向左移动.下列分析正确的是

A. 溶液中c(A2+)增大
B. B的电极反应:B→B2++2e-
C. y电极上有氢气产生,发生还原反应
D. 反应初期,x电极周围出现白色胶状沉淀,随后沉淀也不会溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com