
【题目】下列实验操作或事故处理方法正确的是
A. 金属钠着火,立即用水扑灭
B. 实验结束后,用嘴吹灭酒精灯
C. 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗
D. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应的实验过程如图①、②、③所示,下列有关说法不正确的是
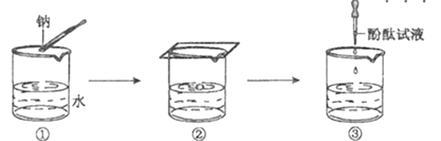
A. 图②中钠熔成小球,说明钠与水反应放热且钠的熔点低
B. 图②中钠四处游动并嘶嘶作响,说明反应产生了气体
C. 图③中滴加酚酞试液后溶液变红,说明有碱性物质生成
D. 钠与水反应的离子方程式是: 2Na+ 2H+=2Na+ + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一定量的苯的同系物A完全燃烧,生成的气体通过浓硫酸后,浓硫酸增重5.4克,再通过KOH溶液后,KOH溶液增重19.8克,(设浓硫酸和KOH溶液的吸收率为100%)。
(1)通过计算确定A的分子式。(写出计算过程)_________________
(2)若0.1molA的氧化产物(被酸性高锰酸钾氧化)恰好被2mol/L100mL的NaOH溶液完全中和。写出A可能的的结构简式。_________________________
(3)若A的核磁共振氢谱中只有2种峰,则写出A的结构简式。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题目要求填写下列空白。
(1)CH3OOCH按官能团的不同分类,有机物类型为____________类;
(2)![]() 按官能团的不同分类,有机物类型为____________类;
按官能团的不同分类,有机物类型为____________类;
(3)将(CH3)2CHCH(CH3)CH(CH3)CH2CH3按系统命名法命名________________________。
(4)将(CH3)2C=CH-CH=CHCH3按系统命名法命名________________________。
(5)燃烧等质量的四种烃:①C2H6 ②C4H8 ③C6H14 ④C7H8,消耗氧气最多的是____________。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr2O7溶液中![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿的主要成分为PbS,含铅可达86.6%。以方铅矿为原料制备铅蓄电池的电极材料PbO2的工艺流程如图所示:
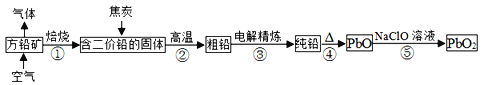
(1)方铅矿焙烧后排出气体的主要成分是______(填化学式),可用于工业制备________。
(2)步骤②中焦炭的作用是________。
(3)“粗铅”的杂质主要有锌、铁、铜、银等。电解精炼时,________作阴极,阴极反应式为________,阳极泥的主要成分是________。
(4)步骤⑤中制备PbO2的离子方程式________。
(5)已知:常温下,Ksp(PbS)=8×10-28、Ka1(H2S)=1.3×10-7、Ka2(H2S)=7.1×10-15。常温下,向Pb(NO3)2溶液中通入H2S气体,发生反应的离子方程式是________;结合数据分析,该反应能否进行得基本完全?________(写出计算推理过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的工业原料,可以制备如下图所示的一系列物质(部分产物未标出)
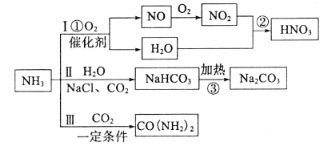
(1)线路Ⅰ为硝酸的制备
写出反应①的化学方程式________;反应②中氧化剂与还原剂的物质的量之比为_______,工业尾气中的氮氧化物常采用碱液法吸收,若NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是_______。
(2)路线为Ⅱ纯碱的制备
写出反应③的化学方程式________,最终得到的纯碱中可能含有NaCl,检验是否存在NaCl的实验方案是________
(3)路线Ⅲ为尿素的制备
写出合成尿素的化学方程式________
(4)实验室中需要少量氨气,写出制备氨气的化学方程式________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com