
【题目】以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验
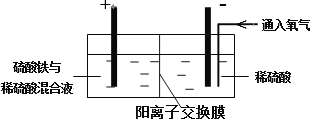
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相)![]() R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是 。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
【答案】(16分)
(1)①吸收硫化氢气体,防止环境污染(1分)
②Fe2+- e-→Fe3+(1分)
(2)2H++2 e-→H2↑ Cu2++2e-→Cu 2Cu+O2+2H2SO4=2CuSO4+2H2O(各1分)
(3)分液漏斗 (1分)
富集Cu2+,分离Cu2+与其它金属阳离子(2分,每个要点1分)
(4)增大H+浓度,使平衡2RH(有机相) + Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生(1分)
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生(1分)
(5) c(H+)>c(SO42-)>c(Cu2+)>c(OH-)(2分)
【解析】试题分析:(1)①根据阳极区的Fe3+的浓度基本保持不变,说明有消耗,阳极区的主要反应,H2S有毒,对环境有污染,因此硫酸铁的作用是吸收硫化氢气体,防止环境污染;②就有生成,因此在阳极区Fe2+-2e-=Fe3+;(2)根据电解原理,以及信息,有气泡产生,2H++2e-=H2↑,有固体产生Cu2++2e-=Cu,固体消失2Cu+O2+2H2SO4=2CuSO4+2H2O;(3)有机相和水相互不相溶,分离时采用分液方法,使用分液漏斗;金属矿中金属含量低,一般先采用富集,因此有机萃取的目的是负极Cu2+,分离Cu2+与其它金属阳离子;(4)2RH(有机相)+ Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相),加入硫酸,增加H+浓度,促使平衡向正反应方向移动,Cu2+进入水相得以再生;(5)200mL0.5mol·L-1的CuSO4溶液中n(Cu2+)=200×10-3×0.5mol=0.1mol,电解一段时间后产生铜单质3.2g,溶液中含有0.05molCuSO4, 2CuSO4+2H2O
R2Cu(有机相)+ 2H+(水相),加入硫酸,增加H+浓度,促使平衡向正反应方向移动,Cu2+进入水相得以再生;(5)200mL0.5mol·L-1的CuSO4溶液中n(Cu2+)=200×10-3×0.5mol=0.1mol,电解一段时间后产生铜单质3.2g,溶液中含有0.05molCuSO4, 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,生成硫酸的物质的量为0.05mol,因水也发生电离产生H+和OH-,Cu2+发生水解,因此离子浓度大小顺序是:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
2Cu+O2↑+2H2SO4,生成硫酸的物质的量为0.05mol,因水也发生电离产生H+和OH-,Cu2+发生水解,因此离子浓度大小顺序是:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】某锂离子电池工作原理如下图所示,电池反应为:Li1-xCoO2+LixC![]() LiCoO2+C。下列说法不正确的是
LiCoO2+C。下列说法不正确的是

A. 放电时,电子从b极经用电器流向a极
B. 放电时,若转移1mol e-,碳材料将增重7 g
C. 充电时,锂离子通过隔膜进入右室
D. 充电时,a极反应:LiCoO2-xe-= Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
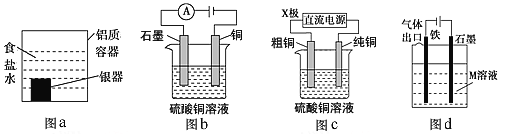
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据2Fe2++Cl2=2Fe3++Cl-;2Fe3++Cu=2Fe2++Cu2+;Fe+Cu2+=Fe2++Cu上述反应判断氧化剂的氧化性强弱顺序正确的是
A.Cl2>Fe3+>Cu2+B.Fe3+>Cl2>Cu2+
C.Cu2+>Fe3+>Cl2D.Cl2>Cu2+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, A的原子半径小于B,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)______________。
(3)BD![]() 中心原子杂化轨道的类型为______杂化;CA
中心原子杂化轨道的类型为______杂化;CA![]() 的空间构型为_______(用文字描述)。
的空间构型为_______(用文字描述)。
(4)1 mol BC-中含有π键的数目为______。
(5)比较D、E元素最简单氢化物的稳定性_______(填化学式,用“>”连接),理由是_______________。
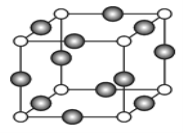
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是____,C原子的配位数是_____。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为______g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点、大立方体的体心和8个小立方体的体心,那么大立方体的面心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
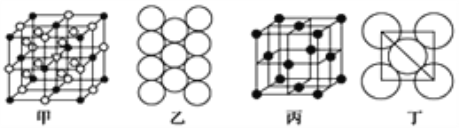
若已知Al的原子半径为r pm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________ g/cm3 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和条件没有全部标出)。已知A、B、E是单质,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。
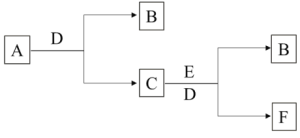
(1)写出A、D的化学式________。
(2)写出A和D反应生成B和C的化学方程式___________。
(3)写出E与C、D反应生成B和F的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂中混有的杂质,其除杂试剂和分离操作都正确的是
编号 | 主要成分 | 杂质 | 除杂试剂 | 分离操作 |
A | 铜粉 | 铁粉 | FeCl3溶液 | 过滤 |
B | Na2SO4 | Na2SO3 | 双氧水 | 结晶 |
C | SO2 | HCl | 饱和Na2CO3 | 洗气 |
D | MgO | Al2O3 | 盐酸 | 过滤 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com