
【题目】下列试剂中混有的杂质,其除杂试剂和分离操作都正确的是
编号 | 主要成分 | 杂质 | 除杂试剂 | 分离操作 |
A | 铜粉 | 铁粉 | FeCl3溶液 | 过滤 |
B | Na2SO4 | Na2SO3 | 双氧水 | 结晶 |
C | SO2 | HCl | 饱和Na2CO3 | 洗气 |
D | MgO | Al2O3 | 盐酸 | 过滤 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验
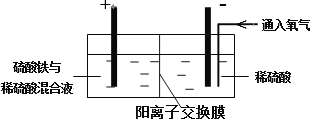
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相)![]() R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是 。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述I、Ⅱ正确并且有因果关系的是 ( )
选项 | 表述I | 表述II |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | ClO2有强氧化性 | ClO2可用于自来水消毒 |
C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
D | NH3·H2O具有碱性 | NH3可使干燥的蓝色石蕊试纸变红 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若原子的最外层电子排布为ns1的元素R的叙述正确的是
A. 一定是ⅠA族元素
B. 一定是金属元素
C. 可能不是金属元素也可能是非金属元素
D. 不是ⅡA族元素就是副族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+B=C+D的能量变化如图所示(E1、E2均为正值),下列说法正确的是
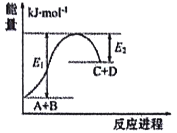
A. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
B. 该反应只有在加热条件下才能进行
C. A和B的总能量一定高于C和D的总能量
D. 该反应吸收的能量为(E1-E2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和Al的合金2.3g全溶于浓硝酸,若反应中硝酸被还原只产生2.24L的NO2气体和168mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入一定量的氢氧化钠溶液,使生成的沉淀的最大质量为
A. 4.255g B. 4.1275g C. 8.51g D. 9.62g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块金属钠投入到硫酸铜溶液中,最终得到的主要产物有 :( )
A. Cu和Na2SO4 B. Cu(OH)2 、Na2SO4和H2
C. Cu、Na2SO4和 H2 D. Cu、Cu(OH)2 、Na2SO4和 H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
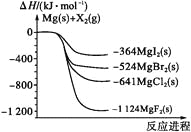
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通入CO气体,另一极通入O2和CO2混合气体,其总反应为:2CO+O2===2CO2 . 则下列说法中正确的是
A. 通CO的一极是电池的正极
B. 负极发生的电极反应是:O2+2CO2+4e-===2CO![]()
C. 负极发生的电极反应是:CO+CO![]() -2e-===2CO2
-2e-===2CO2
D. 通O2的一极做阴极,发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com