
【题目】下列陈述I、Ⅱ正确并且有因果关系的是 ( )
选项 | 表述I | 表述II |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | ClO2有强氧化性 | ClO2可用于自来水消毒 |
C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
D | NH3·H2O具有碱性 | NH3可使干燥的蓝色石蕊试纸变红 |
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
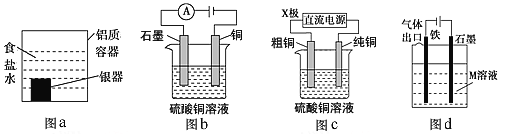
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点、大立方体的体心和8个小立方体的体心,那么大立方体的面心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
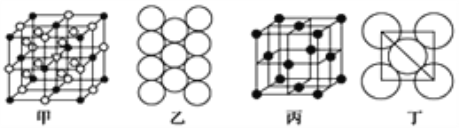
若已知Al的原子半径为r pm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________ g/cm3 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和条件没有全部标出)。已知A、B、E是单质,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。
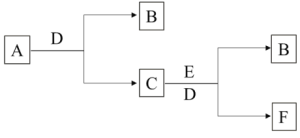
(1)写出A、D的化学式________。
(2)写出A和D反应生成B和C的化学方程式___________。
(3)写出E与C、D反应生成B和F的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
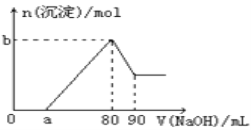
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe 及少量Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
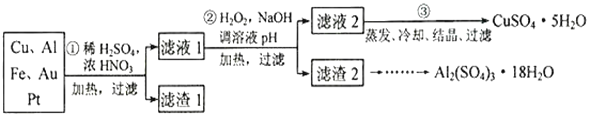
请回答下列向题:
(1)第①步Cu与酸反应的离子方程式___________________,得到滤渣1的主要成分为_________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的Fe2+离子氧化为Fe3+,写出该反应的离子方程式_______________________________,用H2O2做氧化的优点是__________________。
(3)滤渣2的主要成分中Al(OH)3和Fe(OH)3在生产中如何分离两种沉淀,写出反应的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂中混有的杂质,其除杂试剂和分离操作都正确的是
编号 | 主要成分 | 杂质 | 除杂试剂 | 分离操作 |
A | 铜粉 | 铁粉 | FeCl3溶液 | 过滤 |
B | Na2SO4 | Na2SO3 | 双氧水 | 结晶 |
C | SO2 | HCl | 饱和Na2CO3 | 洗气 |
D | MgO | Al2O3 | 盐酸 | 过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法有利于环境保护和可持续发展的是
A. 将工业污水直接用于灌溉农田
B. 将废铅蓄电池的铅泥和废硫酸作深埋处理
C. 推广新能源汽车,建设绿色低碳的交通体系
D. 大力开采煤、石油等化石能源,满足发展需求
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com