
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和条件没有全部标出)。已知A、B、E是单质,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。
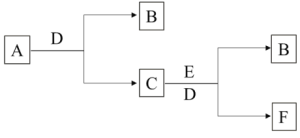
(1)写出A、D的化学式________。
(2)写出A和D反应生成B和C的化学方程式___________。
(3)写出E与C、D反应生成B和F的离子方程式______________。
【答案】Na、H2O 2Na+2H2O=2NaOH+H2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
有A、B、C、D、E、F六种物质,C俗名称为烧碱,C为NaOH,D为无色无味液体,D为H2O,根据框图,单质A与水反应生成一种气体单质B和氢氧化钠,则A为钠,B为氢气,氢氧化钠、水与单质E反应生成氢气,则E为铝,因此F为偏铝酸钠,据此分析解答。
根据以上分析可知A是钠,B是氢气,C是氢氧化钠,D是水,E是铝,F是偏铝酸钠,则
(1)钠和水的化学式分别是Na、H2O;
(2)钠和水反应生成氢气和氢氧化钠的化学方程式为2Na+2H2O=2NaOH+H2↑。
(3)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】有4种碳骨架如下的烃。下列说法正确的是( )
![]()
①a和d是同分异构体 ②b和c是同系物 ③a和d都能发生加聚反应 ④只有b和c能发生取代反应
A. ①② B. ①④
C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验
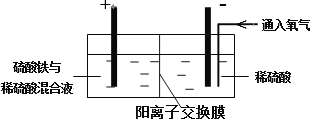
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相)![]() R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是 。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,正确的是( )
A.萃取操作时,应选择有机萃取剂,且萃取剂密度必须比水大
B.用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中的NaCl溶液全部加热蒸干
C.蒸馏操作时,应使温度计水银球与蒸馏烧瓶的支管口相平
D.过滤时,可用玻璃棒不断搅拌,加快过滤速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用10mol/L的浓盐酸配制230mL1mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸___________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等。
(3)若实验遇下列情况,溶液的物质的量浓度是: ①偏高 ②偏低 ③不变
A、加水定容时越过刻度线_________(填序号)。
B、忘记将洗涤液转入容量瓶__________(填序号)。
C、容量瓶内壁附有水珠而未干燥处理__________ (填序号)。
D、量取的浓盐酸置于烧杯中较长时间后配制__________ (填序号)。
(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,若锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1molL—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/[c(H2A)+c(HA—)+c(A2—)]。下列叙述错误的是
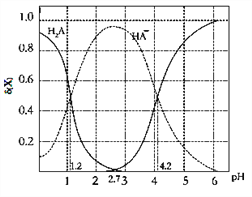
A. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
B. K2(H2A)=10﹣4.2
C. pH=2.7时,[c(HA—)]2/[c(H2A)c(A2—)]=100
D. pH=4.2时,c(HA﹣) =c (A2—)且c(H2A)≈0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述I、Ⅱ正确并且有因果关系的是 ( )
选项 | 表述I | 表述II |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | ClO2有强氧化性 | ClO2可用于自来水消毒 |
C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
D | NH3·H2O具有碱性 | NH3可使干燥的蓝色石蕊试纸变红 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若原子的最外层电子排布为ns1的元素R的叙述正确的是
A. 一定是ⅠA族元素
B. 一定是金属元素
C. 可能不是金属元素也可能是非金属元素
D. 不是ⅡA族元素就是副族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
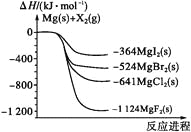
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com