
����Ŀ����֪ A��B��C��D��ԭ������������������ֶ���������Ԫ�أ�A������������������������ A��ԭ�Ӱ뾶С��B��Bԭ�ӵļ۵����Ų�Ϊnsnnpn��D�ǵؿ��к�������Ԫ�ء�E�ǵ������ڵ�p��Ԫ���������ֻ��2�ԳɶԵ��ӣ�FԪ�صĻ�̬ԭ�ӵ����ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӡ�
��1����̬Eԭ�ӵļ۵����Ų�ͼ_______________��
��2��B��C��D��Ԫ�ص�һ�������ɴ�С��˳��Ϊ(��Ԫ�ط��ű�ʾ)______________��
��3��BD![]() ����ԭ���ӻ����������Ϊ______�ӻ���CA
����ԭ���ӻ����������Ϊ______�ӻ���CA![]() �Ŀռ乹��Ϊ_______(����������)��
�Ŀռ乹��Ϊ_______(����������)��
��4��1 mol BC���к�����������ĿΪ______��
��5���Ƚ�D��EԪ������⻯����ȶ���_______(�ѧʽ��������������)��������_______________��
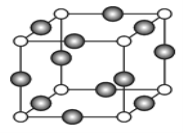
��6��C��F��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ��____��Cԭ�ӵ���λ����_____��������Cԭ�Ӻ�Fԭ�Ӽ�ľ���Ϊanm������٤������ΪNA����þ�����ܶ�Ϊ______g/cm3(�ú�a��NA�ķ��ű�ʾ)��
���𰸡� ![]() N��O��C sp2 �������� 2NA H2O>H2Se O�ķǽ����Դ���Se( ��H2O�й��ۼ��ļ��ܸ���H2Se) Cu3N 6
N��O��C sp2 �������� 2NA H2O>H2Se O�ķǽ����Դ���Se( ��H2O�й��ۼ��ļ��ܸ���H2Se) Cu3N 6 ![]() ��
��![]()
�������������������֪ A��B��C��D��ԭ������������������ֶ���������Ԫ�أ�A������������������������A��ԭ�Ӱ뾶С��B��Bԭ�ӵļ۵����Ų�Ϊnsnnpn������n=2����BΪCԪ����AΪH��Ԫ��D�ǵؿ��к�������Ԫ������D��OԪ����CΪNԪ����E�ǵ������ڵ�p��Ԫ���������ֻ��2�ԳɶԵ��ӣ���E�ļ۵����Ų�ʽΪ4s24p4����EΪSeԪ�أ�FԪ�صĻ�̬ԭ�ӵ����ܲ�ֻ��һ�����ӣ������ܲ���ѳ�����������FΪCuԪ����
��1����̬Seԭ�ӵļ۵����Ų�ͼ![]() ��
��
��2��ͬһ����Ԫ�صĵ�һ�����ܳ�����������������Nԭ�ӵ�2p������ڽ��ȶ��İ����״̬����N�ĵ�һ�����ܸ���ͬ�����ڽ�����Ԫ�أ�C��N��O��Ԫ�ص�һ�������ɴ�С��˳��ΪN��O��C��
��3��CO![]() ����ԭ�ӵļ۵�����ĿΪ
����ԭ�ӵļ۵�����ĿΪ![]() �������ӻ����������Ϊsp2�ӻ���NH
�������ӻ����������Ϊsp2�ӻ���NH![]() ��CH4�ǵȵ����壬����ռ乹��Ϊ����������
��CH4�ǵȵ����壬����ռ乹��Ϊ����������
��4��CN����N2�ǵȵ����壬����ӽṹ�����������к������������ԣ�1 mol CN���к�����������ĿΪ2NA��
��5��O��SeԪ������⻯����ȶ���H2O��H2Se��������O�ķǽ����Դ���Se(��H2O�й��ۼ��ļ��ܸ���H2Se)��
��6�����Ρ�Cu��Ԫ���γɵĻ�����ľ����ṹ��֪���þ����а��������������![]() �����������������
�����������������![]() �����Ը���Ԫ�صij������ϼۿ����жϣ�������������ӡ����������ͭ�������û�����Ļ�ѧʽ��Cu3N��Nԭ�ӵ���λ����
�����Ը���Ԫ�صij������ϼۿ����жϣ�������������ӡ����������ͭ�������û�����Ļ�ѧʽ��Cu3N��Nԭ�ӵ���λ����![]() 6��������Nԭ�Ӻ�Cuԭ�Ӽ�ľ���Ϊa nm�����ı߳�Ϊ2a
6��������Nԭ�Ӻ�Cuԭ�Ӽ�ľ���Ϊa nm�����ı߳�Ϊ2a![]() cm��1mol Cu3N����������������ֱ�Ϊ(
cm��1mol Cu3N����������������ֱ�Ϊ(![]() )g��
)g��![]() ����þ�����ܶ�Ϊ
����þ�����ܶ�Ϊ![]() g/cm3(��
g/cm3(��![]() g/cm3)��
g/cm3)��


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�������֪����ĵ��볣��Ka=1.6��10-5�����������ܶȻ�Ksp(CH3COOAg)=3.7��10-3�������й�˵����ȷ����
A. ������Һ�У�c(CH3COO-)>c(H+)>c(OH-)
B. ����ͬŨ�ȵ�CH3COOH��Һ��CH3COO Na��Һ�������ϣ�������Һ�ʼ���
C. ���¶��£�1mol/L�Ĵ�����Һ�У�����ĵ����Ϊ0.4%
D. ���¶�����Ũ�Ⱦ�Ϊ0.02mol/L��CH3COONa��Һ��AgNO3��Һ��������(���Ի�Ϻ���Һ����ı仯)����CH3COOAg��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.������ͭ���ж����������в���ͭԪ��
B.�������Ϸ�Ϊ��ɫ�������Ϻ���ɫ��������
C.����ͨ������ʱ�������Ĺ����DZ���������ɢ�������
D.ϡ��������;�㷺����Ϊ �²��ϵı��⣬�ɵ���ʹ�ã�����������ɺϽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��������Na2O���ʵ�Na2O2����������ͼ��ʵ��װ�òⶨNa2O2�����Ĵ��ȡ�(�ɹ�ѡ�õķ�Ӧ��ֻ��CaCO3���塢6 mol��L1���ᡢ6 mol��L1���������ˮ)

�ش��������⣺
(1)װ��A�з�����Ӧ�Ļ�ѧ����ʽ��______________________________________��
(2)װ��B��������______________��װ��C��������______________��װ��E��������_____________��
(3)װ��D�з�����Ӧ�Ļ�ѧ����ʽ��______________________________________��
(4)����ʼʱ�����Ʒ������Ϊ2.0 g����Ӧ���������������Ϊ224 mL(��״��)����Na2O2�����Ĵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�ͭ��Ϊԭ�ϣ���ȡ����ͭ������ͭ�Ĺ���������ʾ��
��. ����ͭ����Ҫ�ɷ�ΪCuFeS2����������CaO��MgO��Al2O3������
��. ��������װ�ý��е绯ѧ����ʵ��
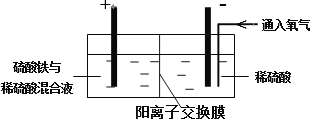
����ѡ��ͭ��ۼ�����������������ٽ��裬ʹ����ܽ⡣��������ͨ������������������������
��. һ��ʱ���ȡ��������Һ�������м����л���ȡ����RH��������Ӧ��
2RH���л��ࣩ+Cu2+��ˮ�ࣩ![]() R2Cu���л��ࣩ+2H����ˮ�ࣩ
R2Cu���л��ࣩ+2H����ˮ�ࣩ
������л��࣬�����м���һ��Ũ�ȵ����ᣬʹCu2+����������
��. �������ͭ��Һ�Ƶý���ͭ��
��1����ͭ��ۼ��������������ἰ��������Ҫ�������·�Ӧ��
CuFeS2+4H��=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S��+2H��
������������������Ҫ������ ��
���������У�������Fe3+��Ũ�Ȼ������ֲ��䣬ԭ���� ��
��2�����������缫�Ͽ�ʼʱ�д������ݲ��������й���������һ��ʱ�������ܽ⡣д�����������Ӧ�ķ�Ӧʽ ��
��3������ʵ���ҽ��в������������л����ˮ�����Ҫʵ�������� �������л���ȡ����Ŀ���� ��
��4�������������л����м���һ��Ũ�ȵ����ᣬCu2+����������ԭ���� ��
��5���������������200mL0.5 mol/L��CuSO4��Һ������ͭ3.2 g����ʱ��Һ������Ũ���ɴ�С��˳���� �������Ե��ǰ����Һ����ı仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z����Ԫ�ص�ԭ������֮�͵���42��XԪ��ԭ�ӵ�4p�������3��δ�ɶԵ��ӣ�YԪ��ԭ�ӵ������2p�������2��δ�ɶԵ��ӡ�X��Y���γɻ�����X2Y3��ZԪ�ؿ����γɸ�һ�����ӡ���ش��������⣺
��1��XԪ��ԭ�ӻ�̬ʱ�ĵ����Ų�ʽΪ________����Ԫ�صķ�����________��
��2��YԪ��ԭ�ӵļ۲���ӵĹ����ʾʽΪ________����Ԫ�ص�������________��
��3��X��Z���γɻ�����XZ3���û�����Ŀռ乹��Ϊ________��
��4����֪������X2Y3��ϡ������Һ�пɱ�����п��ԭΪXZ3�����ﻹ��ZnSO4��H2O���÷�Ӧ�Ļ�ѧ����ʽ��________________________________��
��5���Ƚ�X���⻯����ͬ��ڶ���������Ԫ�����γɵ��⻯���ȶ��ԡ��е�ߵͲ�˵������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У���ȷ���ǣ� ��
A.��ȡ����ʱ��Ӧѡ���л���ȡ��������ȡ���ܶȱ����ˮ��
B.�������ķ���ʹNaCl����Һ������ʱ��Ӧ���������е�NaCl��Һȫ����������
C.�������ʱ��Ӧʹ�¶ȼ�ˮ������������ƿ��֧�ܿ���ƽ
D.����ʱ�����ò��������Ͻ��裬�ӿ�����ٶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ı�0.1molL��1��Ԫ����H2A��Һ��pH����Һ�е�H2A��HA����A2�������ʵ���������(x)��pH�ı仯��ͼ��ʾ[��֪�ģ�x��=c(x)/[c(H2A)+c(HA��)+c(A2��)]�����������������
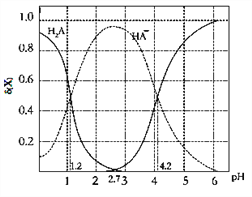
A. ��pH��1.2����Һ�м�KOH��Һ��pH������4.2�Ĺ�����ˮ�ĵ���̶�һֱ����
B. K2(H2A)=10��4.2
C. pH=2.7ʱ��[c(HA��)]2/[c(H2A)c(A2��)]=100
D. pH=4.2ʱ��c(HA��) =c (A2��)��c��H2A����0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ��Al�ĺϽ�2.3gȫ����Ũ���ᣬ����Ӧ�����ᱻ��ԭֻ����2.24L��NO2�����168mL��N2O4���壨�������㵽��״�������ڷ�Ӧ�����Һ�У�����һ����������������Һ��ʹ���ɵij������������Ϊ
A. 4.255g B. 4.1275g C. 8.51g D. 9.62g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com