
【题目】已知:![]() 微溶于水,可溶于硝酸。溶液X中可能含有
微溶于水,可溶于硝酸。溶液X中可能含有![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:
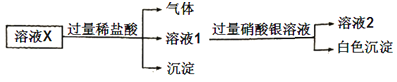
下列说法正确的是( )
A.溶液X中一定含有![]()
![]() 和
和![]()
B.溶液X中一定不含![]() 、
、![]()
C.为确定溶液X中是否含有![]() ,可取溶液2,加入
,可取溶液2,加入![]() 溶液
溶液
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色
【答案】B
【解析】
溶液X与盐酸反应生成气体和沉淀,气体为二氧化碳、沉淀为硅酸,则一定含CO32-、SiO32-,由离子共存可知,一定不含Ca2+、Fe2+,由电荷守恒可知一定存在的阳离子为Na+;溶液1与过量硝酸银反应生成白色沉淀应为AgCl或硫酸银,加盐酸引入氯离子,则不能确定是否含Cl-,且一定不含Br-,不能确定是否含SO42-。
A. 溶液X中一定含有Na+、CO32、SiO32,不能确定是否含Cl,故A错误;
B. 一定含CO32-、SiO32-,由离子共存可知,一定不含Ca2+、Fe2+,与过量硝酸银反应生成白色沉淀一定不含Br-,故B正确;
C. 为确定溶液X中是否含有SO42,可取溶液2加入BaCl2溶液,因溶液2中含银离子,故C错误;
D.X中不含Fe2+,滴入盐酸、双氧水和硫氰化钾溶液后,溶液为无色,故D错误;
故答案选B。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是__________;
(2)氧的原子结构示意图是__________;
(3)形成化合物种类最多的元素是__________;
(4)HF和H2O中,热稳定性较强的是__________;
(5)N和P中,原子半径较小的是__________;
(6)常温下,会在浓硫酸中发生钝化的金属是_________;
(7)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),酸性最强的是_____(填“H2SO4”或“ HClO4”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有一滴KMnO4;电源有a、b两极。若在A、B中充满0.01 mol/L 的KOH溶液后倒立于同浓度的KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如下图所示,则:
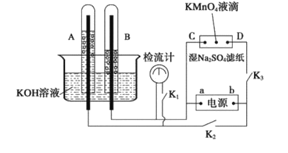
(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为_________(填化学式)。
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为_____________。
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变__________(填“变大”“变小”或“不变”)。
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报导,我国已研制出“可充室温钠—二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时吸收CO2,充电时释放CO2
C. 放电时Na+向碳纳米管移动
D. 放电时的负极反应为2Na-2e-+CO32-=Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源危机,有人提出用CaCO3制取C2H2作燃料。具体反应为:
① CaCO3(s)![]() CaO(s)+CO2(g)
CaO(s)+CO2(g)
② CaO(s)+3C(s)![]() CaC2(s)+CO(g)
CaC2(s)+CO(g)
③ CaC2(s)+H2O(l)![]() CaO(s)+C2H2(g)
CaO(s)+C2H2(g)
(1)制备1mol C2H2(g)需一定量的C(s),这些炭完全燃烧可放热__________kJ
(2)若1mol C2H2完全燃烧可放出热量1298kJ,则将C2H2(g)作为燃料是否合算?说明理由__________。
(3)为什么反应①和②需要高温,反应③只需常温__________(已知有关物质的△Hf(298k)/kJ·mol-1为:CaC2(s):—60,CO2(g):—393,H2O(l):—285,C2H2(g):227,CaO(s):—635,CaCO3(s):—1207,CO(g):—111)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是( )
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS=1110 J/(mol·K)
B. CO(g)===C(s,石墨)+![]() O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=37.301kJ/mol ΔS=184.05 J/(mol·K)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组将废铁屑(含硫化亚铁等杂质)和稀硫酸加入锥形瓶中,加热,充分反应,冷却后加入氨水,制得硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O],装置如下图(夹持仪器略去)。下列说法或操作错误的是
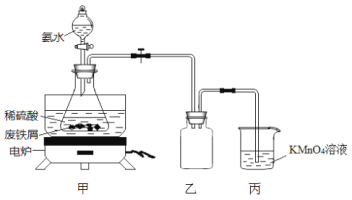
A.乙装置是安全瓶
B.将氨水滴入时,先缓慢打开活塞,再打开玻璃塞
C.KMnO4溶液的作用是吸收H2S等尾气,防止污染空气
D.锥形瓶中发生中和反应的离子方程式:NH3·H2O+H+=NH4++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com