
【题目】下列反应的离子方程式中,书写正确的是
A.碳酸氢钠溶液与氢氧化钠溶液反应:H++OH-=H2O
B.铝与烧碱溶液反应:Al+2H2O+OH-=AlO2-+ 2H2↑
C.碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
D.向偏铝酸钠溶液中通入少量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+ CO32-
科目:高中化学 来源: 题型:
【题目】工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下:

【查阅资料】
①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质;
②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表:

请回答:
(1)操作①的名称是_______,“水浸”后的溶液呈_______性;
(2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________;
(3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________;
(4)“酸化浓缩”时,需继续加入H2SO4,然后_______、结晶、过滤。继续加入H2SO4目的是__________;
(5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如图所示。

①阴极发生的电极反应式为:_____________;
②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混和,发生如下反应:
aA+bB![]() cC(s)+dD
cC(s)+dD
当反应进行一定时间后,测得A减少了n mol,B减少了n /2mol,C增加了3n /2mol,D增加了n mol,此时达到化学平衡:
(1) 该化学方程式中各物质的化学计量数为:
a= 、b= 、c= 、d= 。
(2) 若只改变压强,反应速度发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A B D
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等则该反应为 反应(填“放热”或“吸热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9 :5,此时溶液pH=5
C. 碳酸钠溶液中滴加少量氯水的离子方程式是2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
D. 向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中。A是常见气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)

请回答下列问题:
(1)B的化学式为 。
(2)A的电子式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程 式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是104
B.用乙酰水杨酸![]() 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备![]()
C.向柠檬醛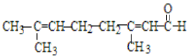 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
D.![]() 、
、![]() 、
、![]() 三种氨基酸脱水,最多可生成 6种二肽。
三种氨基酸脱水,最多可生成 6种二肽。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钾(KCN)是一种有剧毒的物质,贮存和使用时必须注意安全。已知:KCN+H2O2=KOCN+H2O。回答下列问题:
(1)OCN-中所含三种元素的第一电离能从大到小的顺序为_________(用元素符号表示,下同),电负性从大到小的顺序为________;基态氮原子外围电子排布式为__________。
(2)H2O2中的共价键类型为_______(填“σ键”或“π键”) ,其中氧原子的杂化轨道类型为_________;分子中4个原子______(填“在”或“不在”)同一条直线上;H2O2易溶于水除它们都是极性分子外,还因为____________________。
(3)与OCN-键合方式相同且互为等电子体的分子为________(任举一例);在与OCN-互为等电子体的微粒中,由一种元素组成的阴离子是____________。
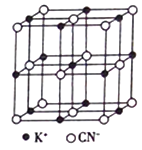
(4)KCN的晶胞结构如图所示。晶体中K+的配位数为_______,若其晶胞参数a=0.648nm,则KCN 晶体的密度为_______g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3的名称为硫代硫酸钠,可视为一个S原子取代了Na2SO4中的一个O原子。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究了自己的预测。
【提出假设】
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH____7(填“>”、“=”或“<”)。
(2)部分学生从S元素化合价推测Na2S2O3与Na2SO4性质相似,均具有较强的____。
【实验探究】取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)。
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
探究① | (3)____ | 溶液pH=8 | (4)____ |
探究② | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5)____ |
【实验结论】
(6)探究①__________。
(7)探究②__________。
【问题讨论】
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意,完成下列问题。
(1)常温下,将1 mL 0.05mol/L的H2SO4溶液加水稀释至100 mL,稀释后溶液的pH= 。若将pH=5的硫酸溶液稀释500倍,稀释后溶液中c(SO42-):c(H+)= 。
(2)某温度时,测得0.01molL-1的NaOH溶液的pH为11,该溶液与pH=5的HCl溶液等体积混合(混合后溶液体积变化忽略不计),混合后溶液pH= 。
(3)常温下,pH=5的H2SO4溶液中由水电离出的H+的浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+的浓度为c2,溶液中![]() =_____________。
=_____________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a :b=___________,若所得混合溶液pH=12,则a:b=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com