
| ||
| ||
| ||
| ||
| ||
| ||
| 25mL |
| 250mL |
| 25mL |
| 250mL |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
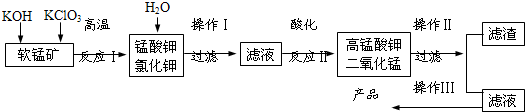
ʵ���ҿ������̿���Ҫ�ɷ�ΪMnO2���Ʊ�KMnO4���������£����̿����������KOH��KClO3�ڸ����·�Ӧ����������أ�K2MnO4����KCl����ˮ�ܽ⣬��ȥ��������Һ�ữ��K2MnO4ת��ΪMnO2��KMnO4����ȥMnO2������Ũ����Һ���ᾧ�õ�����ɫ����״KMnO4����ش�
��1�����̿��Ʊ�K2MnO4�Ļ�ѧ����ʽ��
��������������������������������������������������������������������������������
��2��K2MnO4�Ʊ�KMnO4�����ӷ���ʽ��������������������������������������������
��3������2.5g���̿�MnO280������������ʵ�飬����KMnO4�����۲�����
��4��KMnO4�����ȵľ������ữ��Na2C2O4��Ӧ����Mn2+��CO2���÷�Ӧ�Ļ�ѧ����ʽ������������ ������������������
��5�������Ƶõ�KMnO4��Ʒ0.165g��ǡ����0.335g��Na2C2O4��Ӧ��ȫ�������KMnO4�Ĵ��ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ���ҿ������̿���Ҫ�ɷ�ΪMnO2���Ʊ�KMnO4���������£����̿����������KOH��KClO3�ڸ����·�Ӧ����������أ�K2MnO4����KCl����ˮ�ܽ⣬��ȥ��������Һ�ữ��K2MnO4ת��ΪMnO2��KMnO4����ȥMnO2������Ũ����Һ���ᾧ�õ�����ɫ����״KMnO4��
��ش�
(1�����̿��Ʊ�K2MnO4�Ļ�ѧ����ʽ��������������������������������������
(2��K2MnO4�Ʊ�KMnO4�����ӷ���ʽ��������������������������������������������
(3������2.5g���̿�MnO280������������ʵ�飬����KMnO4�����۲�����
(4��KMnO4�����ȵľ������ữ��Na2C2O4��Ӧ����Mn2+��CO2�÷�Ӧ�Ļ�ѧ����ʽ��
����������������������������������������������������������������������
(5�������Ƶõ�KMnO4��Ʒ0.165g��ǡ����0.335g��Na2C2O4��Ӧ��ȫ�������KMnO4�Ĵ��ȡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com