
【题目】物质爆炸都伴随着能量变化,请回答下列问题:
(1)氯酸钾、火药及磷等组成的混合物极易爆炸。由于KClO3受热分解释放出O2,引发白磷(P4,固体)的燃烧而导致火药爆炸。31 g P4完全燃烧生成五氧化二磷固体释放出a kJ热量。下列说法不正确的是________ (填字母)。
A.KClO3的分解过程中只有共价键断裂没有共价键生成
B.火药爆炸会使周围空气体积迅速膨胀
C.若白磷完全燃烧释放出8a kJ热量,则需要标准状况下的O2体积为224 L
D.易燃易爆物应远离火源
(2)天然气已经成为我国主要的民用清洁能源,但天然气与空气混合达到一定比例后遇明火会发生爆炸,所以安全使用天然气,防止发生爆炸是极为重要的。已知天然气的主要成分甲烷燃烧时的能量变化如图所示。
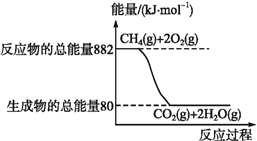
请回答下列问题:
①下列说法正确的是____(填字母)。
A.天然气属于清洁能源,所以它属于新能源
B.甲烷完全燃烧时化学能全部转化为热能
C.标准状况下44.8 L甲烷完全燃烧时有8 mol共价键断裂
D.用天然气做饭时,为使甲烷充分燃烧,通入的空气越多越好
②CH4(g)完全燃烧时生成18 g气态水放出的热量是____kJ。
③若家庭做饭需64160 kJ热量,假设天然气(按CH4算)的热效率为80%,则需要天然气(按CH4算)的质量为____g。
【答案】 A C 401 1 600
【解析】(1)A、KClO3受热分解生成KCl和O2,生成O2时有新的共价键生成,A错误;B、火药爆炸会使周围空气体积迅速膨胀,B正确;C、31gP4完全燃烧生成五氧化二磷固体释放出a kJ热量,则248 g(2 mol)白磷(P4)完全燃烧释放出8a kJ热量,需10 molO2,标准状况下O2的体积为224 L,C正确;D、易燃易爆物与火源接触可能发生爆炸和火灾,所以应远离火源,D正确,答案选A。(2)①A、天然气属于化石能源,不属于新能源,A错误;B、甲烷燃烧过程中大部分化学能转化为热能,但也有部分化学能转化为光能等,B错误;C、CH4完全燃烧的反应方程式为CH4+2O2![]() CO2+2H2O,1 mol CH4完全燃烧断裂4 mol C—H键,标准状况下44.8 L(2 mol)CH4完全燃烧断裂8 mol共价键,C正确;D、用天然气做饭时,通入的空气要适量,只要能使CH4充分燃烧即可,若通入空气过多,空气会带走部分热能,热效率将降低,D错误,答案选C。②由图中数据可知1 mol CH4(g)完全燃烧生成2 mol气态水时放出的热量为(88280) kJ=802 kJ,则生成1 mol气态水时放出的热量为401 kJ。③设需要CH4的物质的量为x,则64160 kJ=80%×x×802 kJ·mol1,解得x=100 mol,则所需CH4的质量为100 mol×16 g·mol1=1600 g。
CO2+2H2O,1 mol CH4完全燃烧断裂4 mol C—H键,标准状况下44.8 L(2 mol)CH4完全燃烧断裂8 mol共价键,C正确;D、用天然气做饭时,通入的空气要适量,只要能使CH4充分燃烧即可,若通入空气过多,空气会带走部分热能,热效率将降低,D错误,答案选C。②由图中数据可知1 mol CH4(g)完全燃烧生成2 mol气态水时放出的热量为(88280) kJ=802 kJ,则生成1 mol气态水时放出的热量为401 kJ。③设需要CH4的物质的量为x,则64160 kJ=80%×x×802 kJ·mol1,解得x=100 mol,则所需CH4的质量为100 mol×16 g·mol1=1600 g。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】有关如图所示有机化合物的性质说法不正确的是( ) 
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1 mol 该化合物最多可以与3 mol NaOH反应
C.既能催化加氢,又能使酸性KMnO4溶液褪色
D.既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
B. 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH- =2BaSO4+AlO2-+ 2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H+ +2I-=2Fe2+ +I2 +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是___________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是_________________,说明该反应属于_________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是________________;
②若观察到烧杯里产生气泡,则说明M溶于水____________(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是______。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O = 4KOH+3O2↑)是放热反应还是吸热反应。
方法(1):选择上述装置________(填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法(2):取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是_____________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应2AB(g)C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为( )
A.△H<0,△S>0
B.△H<0,△S<0
C.△H>0,△S>0
D.△H>0,△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
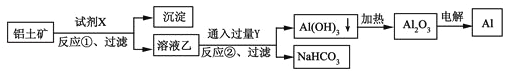
A. 试剂X氢氧化钠溶液
B. 反应①、过滤后所得沉淀为红褐色Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图 , 该元素基态原子结构示意图 . 该元素的名称为 , 形成的单质为晶体.
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:、、 .
(3)试比较下列含氧酸的酸性强弱:H3PO4H3PO3(填“>”、“<”或“=”).
(4)根据价层电子对互斥理论判断:NH3的电子式为中心原子的杂化方式为
杂化,VSEPR构型为 , 分子的立体构型为 .
(5)在下列物质①CO2、②NH3、③CCl4、④C2H2、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填序号).
(6)H2O的沸点(100℃)比H2S的沸点(﹣61℃)高,这是由于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或数据合理的是
A. 工业上常用热还原法冶炼铁和钠
B. 用NaOH溶液能一次鉴别分别含有Mg2+、Cu2+、和Na+的三种盐溶液
C. 从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤: 溶解→过滤→蒸馏
D. 量取16.80mLNa2CO3溶液可选用规格为20mL的量筒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/L NaOH溶液进行滴定,则所需NaOH溶液的体积( )
A.大于20mL
B.小于20mL
C.等于20mL
D.等于5mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com