
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 反应Cu2S+O2![]() 2Cu+SO2生成1molCu,电子转移数为3NA
2Cu+SO2生成1molCu,电子转移数为3NA
B. 常温时,2L1mol/L的醋酸溶液中,所含分子总数小于2 NA
C. 1molFeC13溶于水中,溶液中离子数为4 NA
D. 1molNH2-中含电子数为NA
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。
(1)以丁烯和乙烯为原料制备丙烯的方法被称为“烯烃歧化法",主要反应为C4H8(g)+C2H4(g)![]() 2C3H6(g)
2C3H6(g)
已知相关燃烧热数据:
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1411kJ·mol-1
C3H6(g)+ ![]() O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) △H3=-2539kJ·mol-1
①乙烯的电子式为______________。
②相同质量的C2H4(g)、C3H6(g)和C4H8(g)充分燃烧,放出的热量由多到少的顺序依次为______________(填写化学式)。
③ 上述“烯烃歧化法”的反应的热化学方程式为___________。
(2)“丁烯裂解法”是另一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。
反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:

①平衡体系中的丙烯和乙烯的质量比[![]() ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号)
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号)
A. 300℃ 0.1MPa B. 700℃ 0.1MPa
C.300℃ 0.5MPa D.700℃ 0.5MPa
②有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是__________。
③图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为3L的密闭容器里进行如下反应N2(g)+3H2(g)2NH3(g),反应开始时n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol.求:
(1)试用H2 , N2和NH3的浓度分别表示该反应的反应速率;
(2)求出2min末N2的浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是
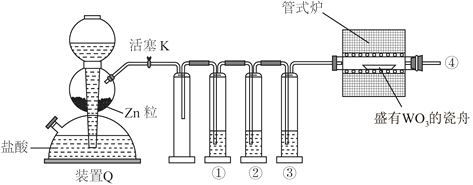
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,甲、乙、丙、丁四种气态烃的分子中所含电子数分别为10、14、16、18,下列关于这四种气态烃的推断正确的是
A. 四种气态烃中至少有两种互为同分异构体
B. 可以用酸性高锰酸钾溶液鉴别乙和丙
C. 丙分子中所有原子均在同一平面上
D. 乙和丁属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10﹣10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 |
回答下列问题:
(1)③的元素符号是 , ①的元素名称是 .
(2)在这8种元素的最高价氧化物的水化物中,酸性最强的化合物的名称是 . ②与⑤形成的化合物的电子式是: , 属化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用分子式表示) .
(4)写出⑥最高价氧化物对应水化物跟⑧的最高价氧化物反应的离子方程式: .
(5)请设计实验比较单质②⑧的金属性,写出简单的实验步骤和现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥热料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

已知下列氢氧化物沉淀完全的pH:
Fe(OH)3 3.0 Fe(OH)2 8.35 Al(OH)3 4.7 Mg(OH)2 10.87
回答下列问题:
(1) 在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是_______,还可使用______代替硝酸。
(2) 沉淀A 的主要成分是_______,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为__________________。
(3) 加氨水过程中加热的目的是_________.沉淀B 的主要成分为_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于加成反应的是 ( )
A.乙烯通入溴水后,溴水褪色B.乙烯通入酸性高锰酸钾溶液后,溶液褪色
C.乙烯在一定条件下与H2反应D.乙烯在一定条件下与H2O反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法中,不正确的是( )
A.Fe2O3可以做油漆的颜料
B.Al2O3可用作耐火材料
C.铝合金比纯铝的熔点更高
D.赤铁矿可用作炼铁的原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com