
����Ŀ������8��Ԫ�ص����ʡ��������±����У��������ڵڶ���������ڣ�
�� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶��10��10m�� | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
�����ͻ��ϼ� | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
��2 | ��3 | ��1 | ��3 |
�ش��������⣺
��1���۵�Ԫ�ط����� �� �ٵ�Ԫ�������� ��
��2������8��Ԫ�ص�����������ˮ�����У�������ǿ�Ļ������������ �� ������γɵĻ�����ĵ���ʽ�ǣ� �� �����������ӡ����ۡ�����
��3���ȽϢܺ͢ߵ��⻯����ȶ��ԣ��÷���ʽ��ʾ�� ��
��4��д��������������Ӧˮ����������������ﷴӦ�����ӷ���ʽ�� ��
��5�������ʵ��Ƚϵ��ʢڢ�Ľ����ԣ�д����ʵ�鲽������� ��
���𰸡�
��1��Be����
��2�������![]() ������
������
��3��NH3��PH3
��4��Al2O3+2OH��=2AlO2��+H2O
��5��ȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ��������
���������⣺��Ԫ�ص����ʿ�֪����ֻ�Щ�2�ۣ����ΪO���ܡ����л��ϼ���ͬ���뾶��ͬ�����ΪP����ΪN����ΪCl�����ԭ�Ӱ뾶��֪����ΪMg����ΪBe����ΪNa����ΪAl����1���۵�Ԫ�ط�����Be���ٵ�Ԫ���������������Դ��ǣ�Be��������2����8��Ԫ�ص�����������ˮ�����У�������ǿ�Ļ�����������Ǹ����ᣮ������γɵĻ�����ΪMgCl2 �� �����ʽ�� ![]() �������Ӽ���Ϊ���ӻ�������Դ��ǣ������
�������Ӽ���Ϊ���ӻ�������Դ��ǣ������ ![]() �����ӣ���3���ǽ�����N��P����ܺ͢ߵ��⻯����ȶ���ΪNH3��PH3 �� ���Դ��ǣ�NH3��PH3����4��������������Ӧˮ����������������ﷴӦ�����ӷ���ʽΪAl2O3+2OH��=2AlO2��+H2O�����Դ��ǣ�Al2O3+2OH��=2AlO2��+H2O����5��������Mg��Al����Ƶļ�ʵ�鲽�������ΪȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ�������ң� ������ˮ��ԭ��ء�����������ˮ����ļ��ԱȽϵȣ������Դ��ǣ�ȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ�������ң�
�����ӣ���3���ǽ�����N��P����ܺ͢ߵ��⻯����ȶ���ΪNH3��PH3 �� ���Դ��ǣ�NH3��PH3����4��������������Ӧˮ����������������ﷴӦ�����ӷ���ʽΪAl2O3+2OH��=2AlO2��+H2O�����Դ��ǣ�Al2O3+2OH��=2AlO2��+H2O����5��������Mg��Al����Ƶļ�ʵ�鲽�������ΪȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ�������ң� ������ˮ��ԭ��ء�����������ˮ����ļ��ԱȽϵȣ������Դ��ǣ�ȡһС��þ����һСƬ��Ƭ��ĥȥ��������Ĥ���ֱ����2֧�Թ��У�������������Ũ�ȵ����ᣬþ�����ᷴӦ�������ң�


 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��D��E��W����ѧ����������Ԫ�أ�ԭ��������������A��ԭ�������������Ǵ�����2����D���������������������D��Eλ��ͬ���ڣ�A��D��E��ԭ������������֮��Ϊ14��W������������Ԫ�أ�ȱ��W�ᵼ��ƶѪ֢״��
��1��A��Ԫ�����ڱ��е�λ����__________________��
��2��������ʵ����Ԫ�������ɽ��͵���_____(����ĸ��ţ���
a . D������������Ӧˮ����ļ�������Mg(OH)2
b. E����̬�⻯����ȶ���С��HF
c. WE3����Һ�����ڿ�ʴͭ�Ƶ�ӡˢ��·��
��3��E�ĵ��ʿ��Դ�NaBr��Һ���û���Br2���ʣ���ԭ�ӽṹ�ĽǶȽ�����ԭ����__________��
��4���ٹ�ҵ���õ�ⷨ�Ʊ�D�ĵ��ʣ���Ӧ�Ļ�ѧ����ʽΪ____________________��
�ڼ������ܵ�ͨ������Ч�ɷ����ռ��D�ĵ��ʣ�ʹ��ʱ�����һ������ˮ����ʱ������Ӧ�Ļ�ѧ����ʽΪ____________________��
��5��W�ĵ��ʿ����ڴ������Է�ˮ�е�NO3-��ʹ��ת��ΪNH4+��ͬʱ�����д��Ե�W��������X���ٽ��к���������
�� ������Ӧ�����ӷ���ʽΪ__________��
�� D�ĵ�����X�ڸ����·�Ӧ�Ļ�ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��һ�־��壬��һ�������¿ɷ�����ͼ��ʾ�ı仯������������ȷ����

��X����������� ��X������ԭ�Ӿ�����������
��Wһ������������ ��W������۵�ܸ�
A. �٢ڢ� B. �٢ڢ� C. ֻ�Т� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������˵����ȷ����
A. ��ӦCu2S+O2![]() 2Cu+SO2����1molCu,����ת����Ϊ3NA
2Cu+SO2����1molCu,����ת����Ϊ3NA
B. ����ʱ��2L1mol/L�Ĵ�����Һ�У�������������С��2 NA
C. 1molFeC13����ˮ�У���Һ��������Ϊ4 NA
D. 1molNH2-�к�������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء�����˵���������ǣ� ��
A.������������������ɫ�����Ϳ��
B.Ư�ۿ�����������ˮ������
C.���������������к���θ��
D.�轺��������װʳƷ�ĸ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����������ĵ���ƽ�ⳣ�����£�
���� | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��1��CH3COOH��H2CO3��H2SO3��������������������__________(�ѧʽ)��
��2��CH3COOH�ĵ���ƽ�ⳣ������ʽΪK=__________��
��3��д��H2CO3�ĵڶ������뷽��ʽ��_____________��
��4��д��H2SO3��Һ��CH3COONa��Һ��Ӧ�����ӷ���ʽ��____________________��
��5���������Ϊ10mL��pH��Ϊ2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ������pH�ı仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��____________(������������ С��������������)����ĵ���ƽ�ⳣ����������__________________��
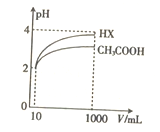
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������������������ȷ���ǣ� ��
A.��״���£�2.24Lˮ�к�Hԭ�ӵ���ĿΪ0.2NA
B.1L 0.1 mol��L��1KNO3��Һ�ﺬOԭ�ӵ���ĿΪ0.3NA
C.2.3g�Ʒ�Ӧ����Na2O��Na2O2�Ļ���ת�Ƶ��ӵ���ĿΪ0.1NA
D.1mol H3O����1molNH4���к����ӵ���Ŀ��Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѹ�������Ͷ�뺬��HCO3-��Cl-��Mg2+��Na+��ˮ��Һ�У�������Ŀ������ǣ� ��
A. HCO3- B. Cl- C. Mg2+ D. Na+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com