
【题目】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。请回答下列问题:
(1)已知:①C2H6 (g)![]() C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
②H2 (g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol
③ C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
则表征 C2H6 (g)燃烧热的热化学方程式为_____。
(2)1000℃时,在某刚性容器内充入一定量的 C2H6 ,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙 烷的平衡转化率为 40%。
①乙烷分解前容器压强为_____Pa ,1000℃时,反应①的平衡常数 Kp=_____Pa[气体分压(P 分)=气体 总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_____40%(填“>”、“<” 或“=”)。
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
① 反应 C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
② 800℃时,控制原料气的总物质的量一定,当 C2H6 和 O2 的物质的量之比为 2:1 时,乙烯的平衡产率最大,而当![]() 较小时,乙烯的平衡产率较低,可能的原因为_____。
较小时,乙烯的平衡产率较低,可能的原因为_____。
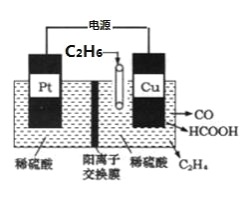
(4)利用电解法可将 C2H6 转化为多种燃料,原理如图所示。铜电极为_____极,该电极上生成 HCOOH 的电极反 应式为_____。
【答案】C2H6(g) + ![]() O2(g) = 2CO2(g) +3H2O(l) ΔH = -1560 kJ·mol1 1.5×105Pa 4×104Pa > 逆活化能
O2(g) = 2CO2(g) +3H2O(l) ΔH = -1560 kJ·mol1 1.5×105Pa 4×104Pa > 逆活化能 ![]() 较小时,C2H6发生深度氧化而导致乙烯的选择性产率降低 阳 C2H6 -10e- + 4H2O = 2HCOOH + 10H+
较小时,C2H6发生深度氧化而导致乙烯的选择性产率降低 阳 C2H6 -10e- + 4H2O = 2HCOOH + 10H+
【解析】
⑴根据盖斯定律将第3个方程式相加得到C2H6 (g)燃烧热的热化学方程式。
⑵①设开始时压强为p根据三段式建立,再列式计算,再根据平衡常数表达式进行计算;②若其他条件不变,该反应是体积增大的反应,刚性容器改为体积可变的密闭容器,则压强减小,向体积增大的方向移动即平衡正向移动。
⑶①根据ΔH =正反应活化能-逆反应活化能<0得出;②氧气过量,C2H6会发生深度氧化。
⑷根据图中信息可知乙烷变为CO或HCOOH,化合价升高,则为阳极。
⑴根据盖斯定律将第3个方程式相加,得到C2H6 (g)燃烧热的热化学方程式为C2H6(g) + ![]() O2(g) = 2CO2(g) +3H2O(l) ΔH = -1560 kJ·mol1,故答案为:C2H6(g) +
O2(g) = 2CO2(g) +3H2O(l) ΔH = -1560 kJ·mol1,故答案为:C2H6(g) + ![]() O2(g) = 2CO2(g) +3H2O(l) ΔH = -1560 kJ·mol1。
O2(g) = 2CO2(g) +3H2O(l) ΔH = -1560 kJ·mol1。
⑵①1000℃时,假设在某刚性容器内充入一定量C2H6,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙烷的平衡转化率为40%,设开始时压强为p。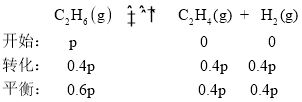 ,则0.6p +0.4p +0.4p =2.1×105,解得p=1.5×105Pa,1000℃时,反应①的平衡常数
,则0.6p +0.4p +0.4p =2.1×105,解得p=1.5×105Pa,1000℃时,反应①的平衡常数![]() ;故答案为:1.5×105Pa;4×104Pa。
;故答案为:1.5×105Pa;4×104Pa。
②若其他条件不变,该反应是体积增大的反应,刚性容器改为体积可变的密闭容器,则压强减小,向体积增大的方向移动即平衡正向移动,转化率增大,因此达到平衡时乙烷的转化率> 40%;故答案为:>。
⑶①反应C2H6(g) + ![]() O2(g)
O2(g) ![]() C2H4(g) + H2O(g) ΔH = -149 kJ·mol1,ΔH =正反应活化能-逆反应活化能<0,正反应活化能<逆反应活化能,因此正活化能和逆活化能中较大的是逆活化能;故答案为:逆活化能。
C2H4(g) + H2O(g) ΔH = -149 kJ·mol1,ΔH =正反应活化能-逆反应活化能<0,正反应活化能<逆反应活化能,因此正活化能和逆活化能中较大的是逆活化能;故答案为:逆活化能。
②当![]() 较小时,乙烯的平衡产率较低,主要是C2H6发生深度氧化而导致乙烯的选择性产率降低;故答案为:
较小时,乙烯的平衡产率较低,主要是C2H6发生深度氧化而导致乙烯的选择性产率降低;故答案为:![]() 较小时,C2H6发生深度氧化而导致乙烯的选择性产率降低。
较小时,C2H6发生深度氧化而导致乙烯的选择性产率降低。
⑷根据图中信息可知乙烷变为CO或HCOOH,化合价升高,则为阳极,因此铜电极为阳极,该电极上生成HCOOH的电极反应式为C2H6 -10e- + 4H2O = 2HCOOH + 10H+;故答案为:阳;C2H6 -10e- + 4H2O = 2HCOOH + 10H+。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】目前大多数城市采用雨污分流的排水体制,污水汇集到一起,进行集中处理。如图是电解法处理某生活污水的装置:
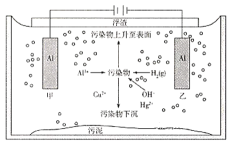
下列叙述正确的是( )
A.甲、乙两个电极均为消耗型电极,不能用石墨代替
B.电解开始时,阴极反应为2H2O+2e-=H2↑+2OH-,阴极区pH升高
C.当阳极有9.0gAl溶解时,阴极一定增重100.5g或32.0g
D.污水中污染物的除去是阳极反应与阴极反应协同作用的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用天然气作为制备甲醇CH3OH的原料。已知:
①CH4(g)+O2(g)CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)CH3OH(g)△H=-90kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为______。
(2)向VL恒容密闭容器中充入a mol CO与2a molH2,在不同压强下合成甲醇。CO的平衡转化率与温度、压强的关系如图所示:

①压强P1______P2(填“<”、“>”或“=”)
②在100℃、P1压强时,平衡常数为______(用含a,V的代数式表示)。
(3)甲醇燃料电池往往采用KOH(或NaOH)浓溶液作电解质溶液,电极采用多孔石墨棒,两个电极上分别通入甲醇和氧气。通入氧气的电极为:通入甲醇的电极上发生的电极反应为:______。用此燃料电池电解某浓度氯化钠溶液,电解一段时间后,收集到标准状况下氢气3.36L,此时燃料电池所消耗的CH3OH的质量为:______。
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液中C(H2CO3)______C(CO32-)(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是( )
A.高温能使合成氨的反应速率加快
B.H2、I2、HI平衡时的混合气体加压后颜色变深
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.红棕色的NO2加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用蒸馏水逐步稀释0.2mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-)B.c(NH4+)
C.![]() D.c(NH3·H2O)
D.c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
①根据上述实验,写出SOCl2和水反应的化学方程式____。
②AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是____。
(2)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() __。
__。
[已知Ksp(BaCO3)=2.2×10–9,Ksp(BaSO4)=1.1×10–10]。
(4)次磷酸(H3PO2)是一种精细化工产品。常温下,K(H3PO2)=1×10–2,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_。(填序号)
A.c(H+) B.![]() C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是____(填“I”或“II”)。
②V1和V2的关系:V1____V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是____。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/LKSCN溶液,静置。 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴mol/LFe(NO3)3溶液。 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅 |
步骤4:向步骤1中余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式____。
②步骤3中现象a是____。
③用化学平衡原理解释步骤4的实验现象____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 互为同分异构体,下列说法不正确的是
互为同分异构体,下列说法不正确的是
A. z的二氯代物有三种
B. x、y的一氯代物均只有三种
C. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D. x、y、z中只有x的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是某香料的有效成分,其分子中含3个六元环。M的一种合成路线如图:

已知①A(C8H8)分子中所有原子可能共平面;②D的核磁共振氢谱上有6个峰;③H和I互为同系物。请回答下列问题:
(1)A的名称是___,E中所含官能团名称是___。
(2)B→C的反应类型是___。
(3)写出H和I反应生成M的化学方程式:___。
(4)T是H的同分异构体,同时具备下列条件的T有___种(不考虑立体异构),其中,苯环上一溴代物只有2种的结构简式为___。
①遇FeCl3溶液发生显色反应;②能发生水解反应和银镜反应。
(5)乳酸(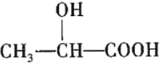 )在医药方面广泛用作防腐剂、载体剂、助溶剂等。参照上述流程,以2-丁烯和乙烯为原料合成乳酸,设计合成路线___(无机试剂任选)。
)在医药方面广泛用作防腐剂、载体剂、助溶剂等。参照上述流程,以2-丁烯和乙烯为原料合成乳酸,设计合成路线___(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com