
【题目】下列说法正确的是( )
A.CH≡CH和CH2=CHCH=CH2互为同系物
B.![]() 互为同分异构体
互为同分异构体
C.有机物![]() 的二氯代物有5种
的二氯代物有5种
D.(CH3)3C-CH=CH2与氢气加成后,生成2,2,3—三甲基戊烷
【答案】C
【解析】
A.同系物必须是同类物质,含有相同数目的相同官能团,CH≡CH的官能团为碳碳三键,属于炔烃,CH2=CH-CH=CH2的官能团为碳碳双键,属于烯烃,CH≡CH和CH2=CH-CH=CH2不是同类物质,不互为同系物,故A错误;
B.同分异构体必须具有相同的分子式,不同的结构,![]() 和
和![]() 的分子式为C6H6,
的分子式为C6H6,![]() 的分子式为C6H8,
的分子式为C6H8,![]() 与
与![]() 和
和![]() 的分子式不同,不互为同分异构体,故B错误;
的分子式不同,不互为同分异构体,故B错误;
C. ![]() 的一氯代物有2种,分别为
的一氯代物有2种,分别为![]() 和
和![]() ,
,![]() 的氢原子再被氯原子取代有4种,示意图为
的氢原子再被氯原子取代有4种,示意图为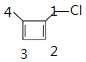 ,
,![]() 的氢原子再被氯原子取代有1种,示意图为
的氢原子再被氯原子取代有1种,示意图为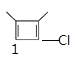 ,共有5种,故C正确;
,共有5种,故C正确;
D. (CH3)3C-CH=CH2与氢气发生加成反应生成(CH3)3C-CH2CH3,(CH3)3C-CH2CH3属于烷烃,名称2,2—二甲基丁烷,故D错误;
故选C。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是( )
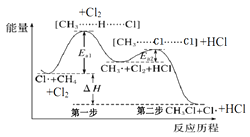
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q原子序数依次增大。已知:X的最外层电子数是次外层的2倍,在地壳中Z的含量最大,W是短周期元素中原子半径最大的主族元素,Q的最外层比次外层少2个电子。请回答下列问题:
(1)X的价层电子排布式是___,Q的原子结构示意图是____。
(2)Y、Z两种元素中,第一电离能较大的是(填元素符号)_____,原因是______。
(3)Z、W、Q三种元素的简单离子的半径从小到大排列的是________。
(4)关于Y、Z、Q三种元素的下列有关说法,正确有是_______;
A.Y的轨道表示式是:
B.Z、Q两种元素的简单氢化物的稳定性较强的是Z
C. Z、Q两种元素简单氢化物的沸点较高的是Q
D.Y常见单质中σ键与π键的数目之比是1:2
(5)Q与Z形成的化合物QZ2,中心原子Q的杂化类型是_____,QZ2易溶于水的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气环境中![]() 的减量化排放受到国内外广泛关注。利用碳还原NO的反应为:
的减量化排放受到国内外广泛关注。利用碳还原NO的反应为:![]() 。回答下列问题:
。回答下列问题:
(1)该反应在常温下可以自发进行,则反应的![]() ________0(填“
________0(填“![]() ”“
”“![]() ”或“
”或“![]() ”),有利于提高NO平衡转化率的条件是________(任写一条)。
”),有利于提高NO平衡转化率的条件是________(任写一条)。
(2)以上反应可分为如下四步反应历程,写出其中第三步的反应:
第一步:![]()
第二步:![]()
第三步:________
第四步:![]()
(3)对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、![]() 、
、![]() ,通入
,通入![]() 使其浓度达到
使其浓度达到![]() 。不同温度下,测得第2小时NO去除率如图所示:
。不同温度下,测得第2小时NO去除率如图所示:
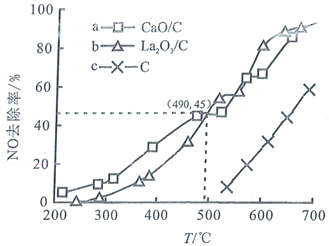
①据图分析,490℃以下,三种情况下反应的活化能最小的是________(用a、b、c表示);![]() 、
、![]() 去除NO效果比C更好,其依据是________(写一条)。
去除NO效果比C更好,其依据是________(写一条)。
②上述实验中,490℃时,若测得![]() 对NO的去除率为60%,则可能采取的措施是________。
对NO的去除率为60%,则可能采取的措施是________。
A.及时分离出![]() B.压缩体积
B.压缩体积
C.恒容下,向体系中通入氮气 D.寻找更好的催化剂
③490℃时的反应速率![]() ________
________![]() ,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为________(保留二位有效数字)。
,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为________(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1) SO2和NOx在空气中存在下列平衡:
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJ·mol-1
2NO2(g) △H=-113.0kJ·mol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________________________________________。
②随温度升高,该反应化学平衡常数变化趋势是______(填“增大”、“减小”、“不变”或“不能确定”)。
(2)工业上利用氯碱工业产品治理含二氧化硫的废气如图是氯碱工业中电解饱和食盐水的原理示意图
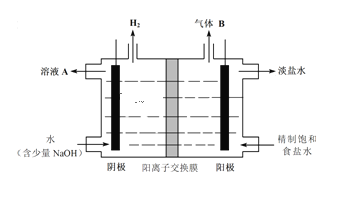
①电解饱和食盐水的化学方程式是_______________________________________________。
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_______________________。
③用含气体B溶液吸收含二氧化硫的废气,其反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知:转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
A.反应①v正(CrO42-)=2v逆(Cr2O72-)时,反应处于平衡状态
B.反应②转移0.6mole-,则有0.2mol Cr2O72-被还原
C.除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D.常温下,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,反应③应调溶液pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲利用如图所示的实验装罝探究苯与液溴的反应。已知:MnO2+2NaBr+2H2SO4![]() Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是()
Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是()
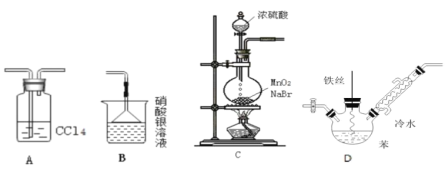
A. 装置A的作用是除去HBr中的溴蒸气
B. 装置B的作用是检验Br
C. 可以用装置C制取溴气
D. 待装置D反应一段时间后抽出铁丝反应会终止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液可能含有Cl﹣、![]() 、
、![]() 、
、![]() 、Mg2+、Fe3+、Na+、K+.由此可知原溶液中( )
、Mg2+、Fe3+、Na+、K+.由此可知原溶液中( )
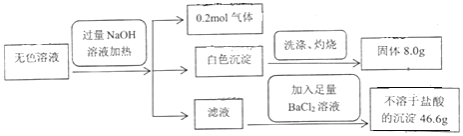
A.至少存在5种离子
B.![]() 、
、![]() 、Mg2+一定存在,Cl﹣可能不存在
、Mg2+一定存在,Cl﹣可能不存在
C.Fe3+、Na+、K+一定不存在
D.Cl﹣一定存在,Na+、K+可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com