
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式_____________。
(2)已知:
C(s)+O2(g) = CO2(g) △H=-437.3kJ·mol -1
H2(g)+1/2O2(g) = H2O(g) △H=-285.8kJ·mol-1
CO(g)+1/2O2(g) = CO2(g) △H=-283.0kJ·mol-1
则煤气化反应C(s)+H2O(g) = CO(g)+H2(g)的焓变△H=___ kJ·mol-1。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol +131.5kJ/mol
【解析】
(1)计算1mol甲烷完全燃烧放出的热量,注明物质的聚集状态与焓变书写热化学方程式;
(2)根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减,构造目标热化学方程式,焓变也进行相应的计算;
(1)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则1mol甲烷燃烧放出的热量为:445.15kJ×1mol×16g/mol![]() 8g=890.3kJ,则CH4燃烧的热化学方程式是:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol,
8g=890.3kJ,则CH4燃烧的热化学方程式是:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol;
(2)已知:①.C(s)+O2(g)═CO2(g)△H=437.3kJmol-1
②.H2(g)+12O2(g)═H2O(g)△H=285.8kJmol-1
③.CO(g)+12O2(g)═CO2(g)△H=283.0kJmol-1
根据盖斯定律,①②③可得:
C(s)+H2O(g)═CO(g)+H2(g)
△H=437.3kJmol-1(285.8kJmol-1)(283.0kJmol-1)=+131.5kJmol-1,


科目:高中化学 来源: 题型:
【题目】某新型有机酰胺化合物M在工业生产中有重要的作用,其合成路线如下:

已知:①A是烃的含氧衍生物,相对分子质量为58,碳和氢的质量分数之和为44.8%,核磁共振氢谱显示为一组峰,可发生银镜反应。
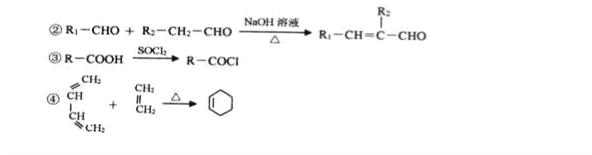
回答下列问题;
(1)E的结构简式为________________,G的名称为_____________。
(2)B中含有官能团的名称为__________________
(3)C→D的反应类型为_____________。
(4)写出B→C的化学反应方程式____________________________.F+H→M的化学反应方程式____________________________
(5)芳香族化合物W有三个取代基,是C的同分异构体,能与FeCl3溶液发生显色反应。0.5molW可与足量的Na反应生成1gH2,且核磁共振氢谱显示为五组峰,符号以上条件的W的同分异构体共有__________种,写出其中一种的结构简式______________。
(7)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备OHC-CH=CH-CHO的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述错误的是( )
A. CS2的结构式为:S=C=S
B. 6CO2+6H2O![]() C6H12O6+6O2,该变化中光能转变为化学能
C6H12O6+6O2,该变化中光能转变为化学能
C. CO2(g)+C(s)![]() 2CO(g)△H>0,△S>0,该反应常温下能自发进行
2CO(g)△H>0,△S>0,该反应常温下能自发进行
D. 可以用酸性高锰酸钾溶液来鉴别乙醇、乙酸和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL H2A溶液中滴加0.1mol/L NaOH溶液.有关微粒的物质的量变化如图.根据图示判断,下列说法不正确的是

A. H2A是二元弱酸
B. 当0 mL<V(NaOH)<20 mL时,一定有:c(OH﹣)+c(HA﹣)+2c(A2﹣)=c(Na+)+c(H+)
C. 当V(NaOH)=10 mL时,溶液中离子浓度关系一定有:c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)
D. 当V(NaOH)=20 mL后,再向溶液中加水稀释,c(H+)减小,c(OH﹣)也减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有pH=3的HCl溶液100 mL,要使它的pH=4,如果加入蒸馏水,需加水_____ mL (假定溶液体积有加和性,下同)。
(2)常温下,将pH=8的NaOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=_______。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是______________.(填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明氯化氢是共价化合物的现象是
A.氯化氢极易溶于水 B.液态氯化氢不能导电
C.氯化氢在水溶液中完全电离 D.氯化氢是无色有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com