
Ⅰ.恒温,容积为1
L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) 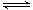 2SO3(g)
ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g)
ΔH=-196.6 kJ·mol-1),请回答下列问题:
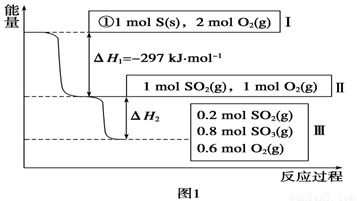
(1)写出能表示硫的燃烧热的热化学方程式:______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)
 CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
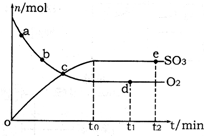
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118 ℃、78 ℃和77 ℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
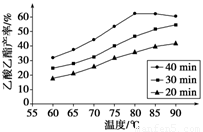
(1)该研究小组的实验目的是___________________________________。
(2)60 ℃下反应40 min与70 ℃下反应20 min相比,前者的平均反应速率________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40 min、温度超过80 ℃时,乙酸乙酯产率下降的原因可能是_________________________________(写出两条)。
Ⅲ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) 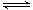 H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)在800 ℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填“A、B、C、D、E”)。
n(CO) n(H2O) n(H2) n(CO2)
A 1 5 2 3
B 2 2 1 1
C 3 3 0 0
D 0.5 2 1 1
E 3 1 2 1
(2)已知在一定温度下,C(s)+CO2(g) 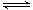 2CO(g)平衡常数为K;
2CO(g)平衡常数为K;
①C(s)+H2O(g) 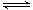 CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2(g) 平衡常数为K1;
②CO(g)+H2O(g) 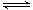 H2(g)+CO2(g) 平衡常数为K2;
H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是______________________________________。
Ⅰ.(1)S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1(1分)
(2)-78.64(1分)
Ⅱ.(1)探究反应温度、反应时间对乙酸乙酯产率的影响;(2分)
(2)小于(1分)
(3)反应可能已达平衡状态,温度升高平衡向逆反应方向移动;温度过高,乙醇和乙酸大量挥发使反应物利用率下降(2分)
Ⅲ.(1)BCE(3分)
(2)K=K1/K2(1分)
【解析】
试题分析:Ⅰ.(1)根据燃烧热的概念和图像所给数据可以写出表示硫的燃烧热的热化学方程式:
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
(2)根据2SO2(g)+O2(g)
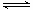 2SO3(g)
ΔH=-196.6 kJ·mol-1和图像中所给数据生成0.8molSO3计算可得。
2SO3(g)
ΔH=-196.6 kJ·mol-1和图像中所给数据生成0.8molSO3计算可得。
Ⅱ. (1) 分析图像可知该研究小组的实验目的是探究反应温度、反应时间对乙酸乙酯产率的影响;(2)本小题考查温度对化学反应速率的影响:当其他条件相同时,温度越高反应速率越快,所以60 ℃下反应40 min与70 ℃下反应20 min相比,前者的平均反应速率小于后者
(2)该反应为放热反应,升温平衡向逆向移动,C2H5OH的沸点为78 ℃,当温度高于80 ℃,反应物乙醇气化,浓度降低也使平衡向逆向移动
Ⅲ. (1)由题给数据可知800 ℃该反应平衡常数K=1,利用浓度商规则Q与K的关系可知要想使反应向正反应方向进行则有Q<K,将题给数据带入计算可得,选BCE。
(2)①—②得C(s)+CO2(g)  2CO(g)。所以K=K1/K2
2CO(g)。所以K=K1/K2
考点:考查燃烧热的概念、热化学方程式书写、外界条件对化学反应速率和化学平衡的影响、平衡常数及数据图像分析能力


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | H-H | C-H | C-C | C=C |
| 吸收或放出的能量 E/(kJ.mol-1) |
435.3 | 414.4 | 345.6 | 615.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始浓度mol/L | 平衡时的浓度mol/L | 平衡时放出的热量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A、平衡时,乙中颜色更深,a>0.008 | ||
B、平衡时,放出的热量:Q1=
| ||
| C、该温度下,该反应的平衡常数K=4 | ||
| D、平衡后,向甲中再充入0.004mol HI气体,再次达到平衡时HI的百分含量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com