
【题目】甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体.它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:

(1)甲物质为 (填化学式);
(2)1mol乙和足量甲反应可生成 mol B物质;1mol丙和足量甲反应可生成 mol B物质;
(3)D能使湿润的有色布条褪色,其褪色原因是 (结合化学反应方程式描述原因);
(4)丙与溶液F反应的化学方程式为 。
【答案】(1)Na2O2;(2)0.5; 0.5;
(3)Cl2 + H2O = H Cl + H ClO,HClO有漂白性;
(4)CO 2 + NaClO = NaHCO3 + HClO 或 CO 2 +2NaClO= Na2CO3 + 2HClO。
【解析】
试题分析:甲是淡黄色化合物,推出甲为Na2O2,乙常温下为无色无味的液体,则乙为H2O,丙为常见无色无味气体且能和过氧化钠反应,则丙为CO2,D为黄绿色气体,则D为Cl2,B为O2,A为NaOH,C为Na2CO3,Cl2 + NaOH→NaCl + NaClO + H2O,CO32- + 2H + = CO2↑ + H2O,CO2 + 2ClO- + H2O = 2HClO + CO32-,(1)根据上述推断,甲为Na2O2;(2)2Na2O2 + 2H2O = 4NaOH + O2↑,因此消耗1molH2O,生成0.5molO2,2Na2O2 + 2CO2 = 2Na2CO3 + O2↑,消耗1molCO2生成0.5molO2;(3)Cl2 + H2O![]() HCl + HClO,HClO具有漂白性;(4)碳酸酸性强于次氯酸,因此有CO2 + 2ClO- + H2O = 2HClO + CO32-,或CO2 + ClO- + H2O = HClO + HCO3-。
HCl + HClO,HClO具有漂白性;(4)碳酸酸性强于次氯酸,因此有CO2 + 2ClO- + H2O = 2HClO + CO32-,或CO2 + ClO- + H2O = HClO + HCO3-。


科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:

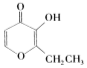


A B C D
(1)化合物A的分子式是 ;A中含有的官能团的名称是 ;
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号) ;
(3)化合物B的核磁共振氢谱中出现 组峰;
(4)1mol D最多能与 mol的氢气发生加成反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“埃博拉”病毒的形状宛如中国古代的“如意”(如图),病毒的基本化学组成是核酸和蛋白质,有的病毒还含有脂质、糖类等其他组分。下列有关有机物的说法不正确的是 ( )

A.漂白粉、双氧水都可以杀灭埃博拉病毒
B.组成病毒的糖类、酯类和蛋白质在一定条件下都可发生水解反应
C.酯在酸性条件下的水解反应属于取代反应,也属于可逆反应
D.糖类和蛋白质的燃烧产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA
C. 通常状况下,NA个CO2分子占有的体积约为22.4 L
D. 通常状况下,71 g Cl2所含原子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示的是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。

(1)进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是________________________,其反应的离子方程式为 。
(2)进行操作④时,所加入的试剂是___________,其目的是_______________,同时要对反应混合物进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=“a”kJ/mol
2Fe(s)+3CO2(g) △H=“a”kJ/mol
(1)己知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=“+”489.0kJ/mol
② C(石墨)+CO2(g)=2CO(g) △H2=“+”172.5kJ/mol
则a=______kJ/mol。
(2)冶炼铁反应的平衡常数表达式K=_______,温度升高后,K 值____(填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。

① 甲容器中CO 的平衡转化率为___________。
② 下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO 的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。

① 在a~c装置中,能保护铁的是________(填字母)。
② 若用d装置保护铁,X极的电极材料应是________(填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com