
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=“a”kJ/mol
2Fe(s)+3CO2(g) △H=“a”kJ/mol
(1)己知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=“+”489.0kJ/mol
② C(石墨)+CO2(g)=2CO(g) △H2=“+”172.5kJ/mol
则a=______kJ/mol。
(2)冶炼铁反应的平衡常数表达式K=_______,温度升高后,K 值____(填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。

① 甲容器中CO 的平衡转化率为___________。
② 下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO 的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。

① 在a~c装置中,能保护铁的是________(填字母)。
② 若用d装置保护铁,X极的电极材料应是________(填名称)。
【答案】(1)-28.5;(2)![]() ;减小;(3)①60%;②ac;(4)①bc;②锌。
;减小;(3)①60%;②ac;(4)①bc;②锌。
【解析】
试题分析:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=“+”489.0kJ/mol;②C(石墨)+CO2(g)=2CO(g) △H2=“+”172.5kJ/mol;①-②×3得到Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g),根据盖斯定律得到反应的焓变=+489.0kJ/mol -3×(+172.5kJ/mol)=-28.5kJ/mol。所以a=-28.5;(2)化学平衡常数是可逆反应达到平衡时各种生成物浓度幂之积与各种反应物浓度幂之积的比,所以根据反应方程式Fe2O3(s)+3CO(g)
2Fe(s)+3CO2(g),根据盖斯定律得到反应的焓变=+489.0kJ/mol -3×(+172.5kJ/mol)=-28.5kJ/mol。所以a=-28.5;(2)化学平衡常数是可逆反应达到平衡时各种生成物浓度幂之积与各种反应物浓度幂之积的比,所以根据反应方程式Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)可知冶炼铁反应的平衡常数表达式K=
2Fe(s)+3CO2(g)可知冶炼铁反应的平衡常数表达式K=![]() ;该反应的正反应是放热反应,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以温度升高后,平衡逆向移动,化学平衡常数K值减小;(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
;该反应的正反应是放热反应,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以温度升高后,平衡逆向移动,化学平衡常数K值减小;(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=![]() = (1+x)3÷(1x)3=64,计算得到x=0.6,所以CO的转化率是60%;
= (1+x)3÷(1x)3=64,计算得到x=0.6,所以CO的转化率是60%;
②Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H=-28.5kJ/mol。a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,正确;b.乙容器中一氧化碳增加,将乙中CO用K=64,代入三段式计算求得CO减少了1.7mol,故CO的转化率为(1.7÷2.0)×100%=70%,转化率乙大,错误;c.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;正确;d.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,错误。(4)①a是电解池,Fe作阳极,发生氧化反应,被腐蚀,错误;B.该装置是电解池,Fe作阴极,发生还原反应,Fe被保护,正确;C.是原电池,由于金属活动性Zn>Fe,所以Fe作正极,被保护,正确;D.该装置一个是原电池,一个为电解池,由于X活动性不能确定,所以Fe可能被氧化,也可能被还原,错误;②若用d装置保护铁,则X的活动性要比Fe强,X极的电极材料应是锌或铝等金属材料。
2Fe(s)+3CO2(g) △H=-28.5kJ/mol。a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,正确;b.乙容器中一氧化碳增加,将乙中CO用K=64,代入三段式计算求得CO减少了1.7mol,故CO的转化率为(1.7÷2.0)×100%=70%,转化率乙大,错误;c.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;正确;d.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,错误。(4)①a是电解池,Fe作阳极,发生氧化反应,被腐蚀,错误;B.该装置是电解池,Fe作阴极,发生还原反应,Fe被保护,正确;C.是原电池,由于金属活动性Zn>Fe,所以Fe作正极,被保护,正确;D.该装置一个是原电池,一个为电解池,由于X活动性不能确定,所以Fe可能被氧化,也可能被还原,错误;②若用d装置保护铁,则X的活动性要比Fe强,X极的电极材料应是锌或铝等金属材料。


科目:高中化学 来源: 题型:
【题目】甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体.它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:

(1)甲物质为 (填化学式);
(2)1mol乙和足量甲反应可生成 mol B物质;1mol丙和足量甲反应可生成 mol B物质;
(3)D能使湿润的有色布条褪色,其褪色原因是 (结合化学反应方程式描述原因);
(4)丙与溶液F反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中c(Na+)=0.2 mol/L,c(Mg2+)=0.25 mol/L,c(Cl-)=0.4 mol/L,如果溶液中还有SO42-,那么c(SO42-)应是
A. 0.1 mol/L
B. 0.3 mol/L
C. 0.15 mol/L
D. 0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位科学家利用Zn 与某浓度的盐酸反应研究影响化学反应速率的因素,他得到的实验数据如下:

利用上述数据,完成下列问题:
(1)画出时间对温度的曲线图。
(2)利用所画的曲线图和上述实验数据,得出关于温度影响反应速率的什么结论?
(3)对比数据B与F,解释F溶于酸那么快的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,0.100 0 mol·L-1Na2CO3溶液25 mL用0.100 0 mol·L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )

A. a点:c(CO32-)=c(HCO3-)>c(OH-)
B. b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C. c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列配制的溶液浓度偏高的是( )
A.配制盐酸用量筒量取盐酸时俯视刻度线
B.配制盐酸定容时,仰视容量瓶刻度线
C.称量4 g NaOH配制0.1 mol·L-1NaOH溶液1 000 mL时,砝码错放左盘
D.NaOH溶解后未经冷却即注入容量瓶至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )

A. 镁作Y电极
B. 电池工作时,Na+向负极移动
C. 废液的pH大于NaClO溶液的pH
D. X电极上发生的反应为ClO-+2H2O - 4e-═ClO3-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与热的氧化铜反应得到N2和金属铜,用如图所示装置可以实现该反应。
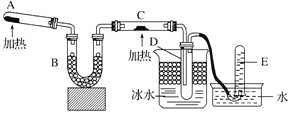
(1)A中加入的物质是 ,发生反应的化学方程式 。
(2)B中加入的物质是 ,其作用是 。
(3)实验时C中观察到的现象是 ,反应的方程式 。
(4)实验时D中观察到的现象是 ,D中收集到的物质是 (填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com