
 在一密闭容器中发生反应N2+3H2??2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
在一密闭容器中发生反应N2+3H2??2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题: ,故答案为:
,故答案为: ;
;| 2x |
| a+b-2x |
| a+b-2x |
| a+b |
| 12x-2x |
| 12x |
| 5 |
| 6 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
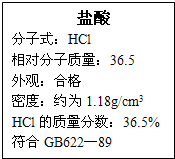 右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )有关的化学方程式:
)有关的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com