
| ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
| ���������mL�� | 50 | 120 | 232 | 290 | 310 |
| 0.112L |
| 22.4L/mol |
| ||
| 1min |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A | B | C | D | |
ͼʾ |
 |
 |
 |
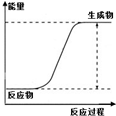 |
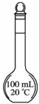
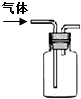
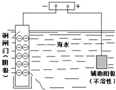
| ˵�� | ��������������һ��������������Һ | ��װ�ÿ����ռ��������� | ��װ�ÿɱ�����բ�Ų�����ʴ | �û�ѧ��ӦΪ���ȷ�Ӧ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȡ���������������ȼú����������β�����������ȷ���������߿������� |
| B��������Ȼʯ��װ�Ҿӣ��ɼ������ڼ�ȩ��Ⱦ���ᵼ��һ�����ķ��������ʵ���Ⱦ |
| C�����������Ӻ�Ǧ������Pb��C2H5��4����������͵Ŀ��������ܣ������ڸ��ƴ������� |
| D��PM2.5��ʾÿ����������ֱ��С�ڻ����2.5�Ŀ�����ĺ�����PM2.5ֵԽ�ߣ�������ȾԽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 2SO2��g��+O2��g��?2SO3��g�� | N2��g��+3H2��g��?2NH3��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �̷� |
| H+ |
| ʯ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| �� |
| ʵ����� | ʱ��Ũ���¶� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800�� | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800�� | C2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820�� | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 һ�����������Ҵ�����û������������ܼ����ȼ״����Ч�ʸ߳�32������ط�ӦʽΪC2H5OH+3O2=2CO2+3H2O����ع�����ͼ�����й��ڸõ�ص�˵������ȷ����
һ�����������Ҵ�����û������������ܼ����ȼ״����Ч�ʸ߳�32������ط�ӦʽΪC2H5OH+3O2=2CO2+3H2O����ع�����ͼ�����й��ڸõ�ص�˵������ȷ����| A���ŵ�����У���Դ�ڲ���H+������������Ǩ�� |
| B��ͨ���Ҵ��ĵ缫�Ǹ��� |
| C���õ�ص�������ӦΪ��4H++O2+4e-=2H2O |
| D���øõ����Ϊ��Դ���ö��Ե缫��ⱥ��NaCl��ˮ��Һʱ��ÿ����0.2 mol C2H5OH������������״������������Ϊ26.88 L |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com