
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
分析 II.根据电子得失守恒和原子守恒书写化学方程式;连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇;
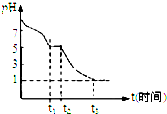
III.(1)Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠;(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体,其中亚硫酸钠是氧化产物,而Na2S2O3中S是+2价,则根据氧化还原反应中电子得失守恒可知气体应该是SO2.根据反应Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O可知要检验硫代硫酸钠;
(3)保险粉与过量的H2O2在水溶液中反应生成硫酸盐,结合质量守恒和电荷守恒书写.
解答 解:II.反应中S元素的化合价从+4价降低到+3价,得到1个电子.甲酸钠中碳元素的化合价从+2价升高到+4价,则根据电子得失守恒和原子守恒可知反应的化学方程式为2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O.连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品,
故答案为:2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O; 乙醇;
III.(1)Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为 2S2O42-+O2+2H2O=4HSO3-.t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠,则溶液中主要阴离子符号是SO42-,故答案为:2S2O42-+O2+2H2O=4HSO3-;SO42-;
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体,其中亚硫酸钠是氧化产物,而Na2S2O3中S是+2价,则根据氧化还原反应中电子得失守恒可知气体应该是SO2.根据反应Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O可知要检验硫代硫酸钠,则只需要取少量完全分解的固体产物于试管中,加入稀盐酸,如果有淡黄色沉淀,则有Na2S2O3存在,故答案为:SO2;
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
点评 本题考查氧化还原反应、水解反应、物质制备和检验实验设计与探究,涉及对反应原理、装置及操作的分析评价、离子方程式的书写等,注意对物质性质信息的应用,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH、蔗糖、NH3•H2O | B. | NH4Cl、HClO、Na2S | ||
| C. | CH3COONa、HCl、BaSO4 | D. | NaCl、SO2、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023个 | |
| B. | 1 mol Cl2参加反应转移电子数一定为2 NA个 | |
| C. | 48gO3与O2的混合气体中含有的氧原子数为3NA 个 | |
| D. | 从1L0.5 mol/LNaCl溶液中取出100mL,剩余溶液中NaCl物质的量浓度为0.45mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性小组探究乙酸乙酯的反应机理,实验如下:
某研究性小组探究乙酸乙酯的反应机理,实验如下:| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |


 后脱水,失水有两种可能分别生成
后脱水,失水有两种可能分别生成 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有不法商贩才使用食品添加剂 | |
| B. | 凡是食品添加剂均对人体有害 | |
| C. | 在限量范围内使用食品添加剂不会对人体造成危害 | |
| D. | 味精是食品添加剂,而碘盐中的“碘”不是添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 偏高 | B. | 偏低 | C. | 准确 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com